Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
Considerando-se a seguinte reação, que envolve íons do
átomo de cobre 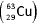 : Cu2+ (aq) + e- → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o
número de prótons, elétrons e nêutrons da espécie iônica de
cobre produto dessa reação.
: Cu2+ (aq) + e- → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o
número de prótons, elétrons e nêutrons da espécie iônica de
cobre produto dessa reação.
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.
Sobre a reação a seguir é CORRETO afirmar:
AsF3(g) + SbF5(l) → [AsF2]+[SbF6]-
(s)
Várias são as propriedades de metais de transição comparadas às dos metais do grupo principal, como podemos observar no quadro a seguir.
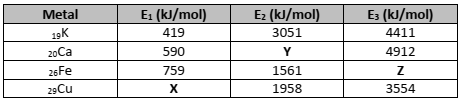
As letras X, Y e Z correspondem a valores de energia de ionização para os determinados elementos. Assinale a
afirmativa correta em relação aos valores de X, Y ou Z.
“Uma série de experiências sob a direção de Ernest Rutherford, em 1911, forneceu uma ideia mais clara sobre a natureza do átomo. Essas experiências foram conduzidas por Johannes Geiger, físico alemão que trabalhava com Rutherford e Ernest Marsden, um estudante em Cambridge. Eles bombardearam uma lâmina fina de ouro com partículas alfa. Com uma tela fluorescente, observaram o grau de espelhamento das partículas alfa. A maioria delas atravessava a lâmina com alteração na direção. Algumas, entretanto, eram fortemente refletidas. Os números relativos de partículas alfa refletidas a diferentes ângulos eram contados. Por análise matemática das forças envolvidas, Rutherford demonstrou que o espalhamento era causado por uma carga central de grande volume, carregada positivamente e situada no interior do átomo de ouro.”
(Adaptado de Masterton, 2009.)
Sobre o núcleo central descoberto por Rutherford, analise as afirmativas a seguir.
I. Possui uma carga positiva de valor igual ao total da carga negativa dos elétrons nas camadas externas do núcleo.
II. É responsável por mais de 99,9% da massa do total do átomo.
III. Possui um diâmetro equivalente a apenas 0,01% do diâmetro do próprio átomo. Se o átomo pudesse ser estendido para cobrir esta página, o núcleo seria praticamente invisível sob a forma de um pequeno ponto cerca de 10 vezes menor do que o ponto que termina essa frase.
Estão corretas as afirmativas
“Uma série de experiências sob a direção de Ernest Rutherford, em 1911, forneceu uma ideia mais clara sobre a natureza do átomo. Essas experiências foram conduzidas por Johannes Geiger, físico alemão que trabalhava com Rutherford e Ernest Marsden, um estudante em Cambridge. Eles bombardearam uma lâmina fina de ouro com partículas alfa. Com uma tela fluorescente, observaram o grau de espelhamento das partículas alfa. A maioria delas atravessava a lâmina com alteração na direção. Algumas, entretanto, eram fortemente refletidas. Os números relativos de partículas alfa refletidas a diferentes ângulos eram contados. Por análise matemática das forças envolvidas, Rutherford demonstrou que o espalhamento era causado por uma carga central de grande volume, carregada positivamente e situada no interior do átomo de ouro.”
(Adaptado de Masterton, 2009.)
Podemos observar no trecho que há incoerência relacionada à experiência de Rutherford e seus colaboradores.
Assinale a alternativa que refere-se ao ERRO encontrado no trecho.
Para a reação:
H2(g) + CO2(g) ↔ H2O(g) + CO(g)a 700°C, a constante de equilíbrio para concentrações Kc = 0,534. Calcule o número
de mols de H2(g) presentes no equilíbrio, se uma mistura de 0,300 mol de
CO(g) e 0,300 mol de H2O(g) for aquecida a 700°C em um recipiente de 10,0 L.
Na mistura, a pressão parcial, em atm, do CO2 é
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
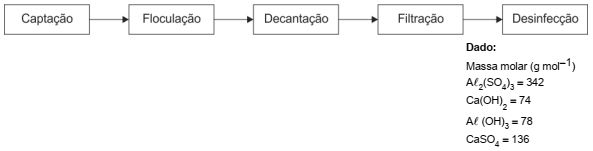
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que