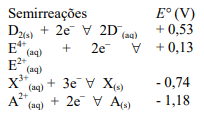Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023
moléculas de H2(g) para a formação de 32,0 g de metano.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão,
na mesma proporção molar da reação apresentada, a queima
de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto
de potássio (K2S).
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato
de potássio e o cátion do nitrato de alumínio é maior que
250,0 g/mol.
Sobre as propriedades dos gases ideais, julgue as sentenças a seguir:
I. O volume de um gás, à temperatura constante , diminui com o aumento da pressão.
II. O aumento da temperatura de um gás, à pressão constante , causa diminuição do volume do gás.
III. Um processo termodinâmico que ocorre a volume constante é chamado de processo isocórico.
Está(ão) correta(s) a(s) sentença(s):
Uma reação de simples troca é apresentada na alternativa:
O elemento químico chamado Rubídio (Rb) apresenta a seguinte configuração eletrônica :
Com base em sua configuração eletrônica , pode-se afirmar que o Rubídio no sistema de classificação periódica dos elementos pertence ao grupo dos:
Um cátion trivalente é apresentado na alternativa
Átomos diferentes que apresentam o mesmo número de nêutrons são chamados:
A configuração eletrônica do átomo de Flúor que possuiZ = 9 e A = 19 é apresentada na alternativa :
O século XVIII foi marcado por grandes revoluções científicas, em relação a matéria coexistiam pelo menos duas ideias que tentavam explicar o seu comportamento. Analise as afirmações abaixo:
( ) O grupo de Georg Ernst Stahl, foi o formulador da teoria do Flogístico.
( ) O flogístico era considerado o responsável pela combustibilidade, de modo que submetendo os metais e substâncias combustíveis a processos de combustão ou calcinação o flogístico era liberado, segundo Stahl.
( ) O grupo de Lavoisier defendia que a combustão, a calcinação e a respiração estavam envolvidas na absorção de oxigênio.
( ) Uma das principais causa da crise e posterior revolução científica no século XVIII foi o desenvolvimento da Química Pneumática, que proporcionou a descoberta do hidrogênio, permitindo que se compreendesse a sua reatividade química.
( ) Os metais, ou mesmo o hidrogênio, que segundo Lavoisier eram compostos, no sistema flogista foram definidos como substâncias simples.
Assinale a alternativa que contém a sequência CORRETA, de cima para baixo.
Atualmente existe uma diversidade de técnicas anal [ticas para a se determinar a composição química, mineralógica e microestrutural de compostos orgânicos e inorgânicos. Com relação aos métodos instrumentais de análise marque (V) para as afirmativas verdadeiras e (F), para as falsas.
( ) Os espectros de absorção de radiação no ultravioleta e no visível são um instrumento que pode ser usado para a identificação de compostos orgânicos insaturados e também na elucidação de suas estruturas.
( ) A difração de Raio-X usa a lei de Bragg para calcular a distância entre camadas atômicas em um cristal. Esta técnica é de grande interesse para identificação dos elementos químicos presentes em uma amostra e para obtenção de estruturas moleculares e cristalinas.
( ) A espectroscopia de energia dispersiva pode ser utilizada para a determinação qualitativa e quantitativa da composição de amostras sólidas e líquidas, esta usa o princípio de identificação pelo raio-X emitido através da interação inelástica do feixe eletrônico com a amostra.
( ) A fluorescência de Raio-X é uma técnica não destrutiva que envolve o uso da emissão de Raio-X para se obter uma análise elementar quantitativa de materiais no estado sólido e líquido.
( ) A cromatografia gasosa pode ser usada para análises qualitativas e quantitativas. Na cromatografia gás liquido a fase móvel é um gás, enquanto a fase estacionária é um líquido retido na superfície de um sólido inerte por adsorção ou ligação química.
Assinale a alternativa que contém a sequência CORRETA de cima para baixo.
No espectro no infravermelho, o pico que corresponde a uma vibração de estiramento C―H de um ou mais grupos alcano, expresso em cm-1, ocorre na faixa de
As Estações de Tratamento de Água (ETA) utilizam gás cloro no processo de desinfecção, que consiste na utilização de um agente químico ou não químico para inativação de microrganismos patogênicos presentes na água. Um método para obtenção desse gás está representado a seguir, pela equação química não balanceada
HCl + MnO2 → MnCl2 + H2O + Cl2
Se reagirmos 100,0 g de HCl com 100,0 g de MnO2, encontraremos que o reagente limitante e a massa de gás cloro obtida nessas condições, expressa em gramas, serão, respectivamente,
Dados: Massas molares (g mol-1): H = 1; O = 16; Cl = 35,5; Mn = 55