Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
O rendimento quântico é uma medida da taxa de eventos
induzidos pela radiação dividida pela taxa de absorção de
fótons.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A fosforescência é um processo fotofísico lento, pois envolve uma transição radioativa entre estados de mesma multiplicidade.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A absorção de energia por uma molécula ocorrerá somente se
as distâncias internucleares nos seus estados fundamental e
excitado forem iguais.
A fotoluminescência é um fenômeno que envolve unicamente transições entre níveis eletrônicos na matéria.

Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
De acordo com a TOM, o íon molecular O2+
possui ordem de
ligação maior do que a molécula neutra de O2.

A TOM mostra que, no estado fundamental de energia, a molécula de O2 apresenta todos os elétrons emparelhados e, por esse motivo, não apresenta comportamento magnético.

Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6 , julgue o próximo item, de acordo com a teoria do campo cristalino.
Na hemoglobina com uma molécula de H2O substituindo a
molécula de O2, a energia de estabilização do campo cristalino
é igual a - 0,4 × Δoct, em que Δoct é o valor do desdobramento
do campo cristalino.

Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6 , julgue o próximo item, de acordo com a teoria do campo cristalino.
A oxiemoglobina possui 4 elétrons desemparelhados e, por este
motivo, apresenta comportamento paramagnético.

A partir das informações fornecidas, conclui-se que a molécula de H2O é um ligante de campo mais fraco do que a molécula de O2.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 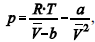 julgue o item que segue.
julgue o item que segue.
A temperatura T2 é inferior àquela verificada imediatamente
antes da compressão.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Átomos de ferro e de manganês com números de massa iguais
a 55 e 54, respectivamente, possuem o mesmo número de
nêutrons.


A partir das posições relativas dos elementos na tabela periódica, é possível inferir que um átomo neutro de ferro apresenta maior raio atômico do que um átomo neutro de manganês.
C6H12O6(aq) → C2H6O(aq) + CO2(g)
(Massas molares (g mol-1 ): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
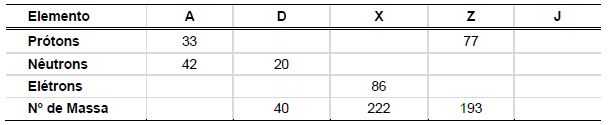
Supondo que os elementos A, D, X, Z e J possam ocorrer na forma de isótopos, e com base nas informações contidas na tabela, é correto afirmar que:
Para a remoção de cromo hexavalente (Cr6+) pode-se utilizar dióxido de enxofre (SO2). A redução do Cr6+ se dá em meio ácido com pH entre 2 e 3. Após a neutralização com hidróxido de cálcio [Ca(OH)2], em pH 8 a 9, o cromo precipita como hidróxido de cromo III (Cr(OH)3). As reações envolvidas são:
− Redução: 3 SO2 + 2 H2CrO4 + 3 H2O → Cr2(SO4)3 + 5 H2O
− Precipitação: Cr2(SO4)3 + 3 Ca(OH)2 → 2 Cr(OH)3 + 3 CaSO4
− Estequiometricamente é necessário na redução 2,0 g de SO2/g Cr6+ e de 2,0 g de H2SO4 / g Cr6+
− Na precipitação utiliza-se 2,6 g de Ca(OH)2 /g Cr6+
Para tratar um efluente de 8,0 m3 contendo 0,50 g de g Cr6+/L de efluente, o consumo de SO2, H2SO2 e Ca(OH)2 são, respectivamente:
I. Átomos que apresentam seus elétrons de valência exclusivamente no subnível s possuem maior eletronegatividade do que átomos com elétrons de valência no subnível p. II. O caráter iônico de uma ligação química depende da diferença de eletronegatividade entre os átomos envolvidos. III. Todos os halogênios apresentam 7 elétrons no subnível p do último nível eletrônico.
São VERDADEIRAS apenas a(s) afirmativa(s):