Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
O processo de oxidação de minérios é comumente empregado para reduzir seu teor de carbono. Desse modo, qual é a massa de oxigênio, em kg, necessária para reduzir o teor de carbono de 5% para 2% em 50 toneladas de minério?

Em um experimento, para determinar a massa atômica de um elemento, foi constatado que a massa determinada era 140 vezes mais pesada do que um átomo de hidrogênio. Sabendo que o número de prótons é igual a 59, determine o número de átomos em um 1 kg de amostra desse elemento:

Considere que um frasco de quartzo de alta pressão com volume de 80 mL está inserido em um forno de micro-ondas e suponha que, dentro dele, exista apenas uma fase de vapor de água a 280 oC e 80 bar. Se essa amostra de água for resfriada até 4 oC e 1 atm, qual será o volume, em mL, de líquido?

No que se refere às ligações químicas e à geometria molecular, julgue o item subsecutivo.
No modelo de repulsão de pares eletrônicos da camada
de valência, regiões de densidade eletrônica aumentada
assumem posições tão separadas quanto possível e a
geometria da molécula é identificada referindo-se às
localizações dos átomos na estrutura resultante.
Com relação à classificação periódica e às propriedades químicas mais importantes dos elementos, julgue o item que se segue.
Os gases nobres são encontrados naturalmente como
gases diatômicos não reativos. O gás hélio, por exemplo,
é duas vezes mais denso que o ar atmosférico. Pelo fato
de não ser inflamável, ele é usado para encher balões e
dirigíveis.
Com relação à classificação periódica e às propriedades químicas mais importantes dos elementos, julgue o item que se segue.
O raio atômico, o raio iônico, a energia de ionização e a
afinidade eletrônica são algumas das propriedades
periódicas dos elementos.
No que diz respeito à estrutura atômica da matéria e aos modelos atômicos, julgue o item a seguir.
No modelo atômico de Bohr, denominado átomo
nuclear, não existe nenhuma região de grande
concentração de carga positiva ou negativa. As cargas
estão uniformemente distribuídas pela esfera. Esse
modelo desconsiderou que no átomo os valores de
energia são quantizados e as transições eletrônicas
envolvem liberação e absorção de energia.
O carbonato de cálcio é um composto de extrema importância comercial, utilizado na fabricação de cimento, em cremes dentais e até para diminuir a acidez dos vinhos. Dada a reação de decomposição do carbonato de cálcio CaCO3(s)→ CaO(s) + CO2(g), se fossem usados 30g de CaCO3, o volume de CO2 obtido, considerando-se as CNTP, seria de (Dados: Massas molares g/mol: Ca = 40; C = 12; O = 16.)
I. O metal mercúrio flutua na água. II. É líquido na temperatura ambiente. III. Na tabela periódica, ele é considerado elemento de transição. IV. A uma temperatura de 0ºC, ele se encontra no estado sólido.
Está(ão) correta(s):
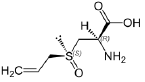
Sobre a aliina, é correto dizer-se que (Dados: massas molares g/mol: C = 12; H = 1; N = 14; O = 16; S = 32.)
Considerando os conceitos de átomo, estados da matéria e reações químicas, julgue o item seguinte.
Uma reação química é o processo de mudança química da matéria, isto é, a conversão de uma ou mais substâncias em outras substâncias.Considerando os conceitos de átomo, estados da matéria e reações químicas, julgue o item seguinte.
A menor partícula que pode existir de um elemento é
denominada de átomo, que é uma espécie eletricamente
neutra que consiste em um núcleo rodeado de elétrons.
Com relação aos significados de mistura, molécula e substância, julgue o item a seguir.
Molécula é a menor porção de um composto, com um
grupo variável de átomos ligados em um arranjo mutável
e eletricamente neutro.
