Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.032 questões
Para cada átomo a seguir foi atribuído um número.
(0)Li ________ (3)Be ________ (6)F ________ (10)Cl ________ (20)Na
A soma dos números que correspondem ao átomo com o maior raio e ao átomo com a maior primeira energia de ionização é:
Sobre a técnica de fotometria de chama, assinale a única afirmativa CORRETA.
No laboratório de química analítica, emprega-se um padrão externo para calibrar instrumentos e procedimentos, quando não há efeitos interferentes advindos dos componentes da matriz presentes na solução do analito.
Assinale a afirmativa CORRETA sobre a curva de calibração.
Em linhas gerais, a análise gravimétrica inclui etapas que devem ser efetuadas na seguinte ordem:
Análise baseada na medida indireta da massa de um (ou mais constituinte) de uma amostra. Medida indireta deve ser entendida como converter determinada espécie química em uma forma separável do meio em que se encontra, para então ser recolhida e, através de cálculos estequiométricos, determinar a quantidade real de um certo elemento ou composto químico, constituinte da amostra inicial.
Análise quantitativa que se realiza para determinar a concentração de uma solução. Permite dosar uma solução e determinar a sua quantidade por intermédio de outra solução de concentração conhecida. Sendo que a solução padrão é a que se conhece a concentração, e a solução problema é aquela da qual procura-se o valor.
A radioatividade foi descoberta no século XIX. Até esse momento predominava a ideia de que os átomos eram as menores partículas da matéria. Com a descoberta da radiação, os cientistas constataram a existência de partículas ainda menores que o átomo, tais como: próton, nêutron, elétron. Analise as afirmativas seguintes, relacionadas a radioatividade, e marque a alternativa CORRETA.
I. A radioatividade natural ou espontânea é a que se manifesta nos elementos radioativos e nos isótopos que se encontram na natureza.
II. A radioatividade artificial ou induzida é aquela produzida por transformações nucleares artificiais.
III. A radioatividade geralmente provém de isótopos como urânio-235, césio-137, cobalto-60, tório232, que são fisicamente estáveis e radioativos, possuindo uma constante e rápida desintegração.
O conhecimento atual das propriedades dos elementos nos permite reuni-los em cinco grupos diferentes, considerando as principais propriedades químicas e as características físicas das substâncias simples que eles formam. Analise as afirmativas seguintes, relacionadas a tabela periódica e marque a alternativa CORRETA.
I. Os gases nobres apresentam como a principal característica a inércia química.
II. O hidrogênio não se enquadra em nenhum grupo da tabela periódica.
III. Os semi-metais apresentam semicondução de corrente elétrica.
IV. Os ametais formam cátions ao produzir substâncias compostas.
As misturas homogêneas são denominadas soluções. Do ponto de vista prático, consideramos que as soluções são formadas de um solvente e um ou mais solutos. Analise as afirmativas seguintes, relacionadas às soluções e marque a alternativa CORRETA.
I. Material homogêneo é aquele que possui uma única fase, ou seja, é monofásico.
II. Material ou sistema heterogêneo é aquele que possui duas ou mais fases.
III. As dispersões coloidais sofrem sedimentações somente pela ação de uma ultracentrífuga.
Relacione a Coluna 1 à Coluna 2, associando o tipo de reação química com a respectiva equação.
Coluna 1
1. Reação de neutralização.
2. Reação de precipitação.
3. Reação de oxirredução
Coluna 2
( ) Cu(s) + 4HNO3(aq) -> Cu(NO3)2(aq) + 2H2O(l)+2NO2(g)
( ) Mg(NO3)2(aq) + 2NaOH(aq) -> Mg(OH)2(s) + 2NaNO3(aq)
( ) 2HNO3(aq) + Ca(OH)2(s) -> 2H2O(l) + Ca(NO3)2(aq)
( ) Mg(s) + 2HCl(aq) -> MgCl2(aq) + H2(g)
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
X: 1s2 Y: 1s2 2s2 2p5 Z: 1s2 2s2 2p6 3s2 3p5
Com relação a esses elementos químicos (X, Y e Z), as seguintes afirmações foram feitas:
1) X apresenta a maior energia de ionização. 2) Y e Z apresentam o mesmo raio atômico. 3) Y e Z pertencem ao mesmo grupo da Tabela Periódica.
Está(ão) correta(s) a(s) afirmativa(s):
Dados Massa Atômicas em g/mol: Fe= 56 O= 16 H= 1
Entre eles houve um modelo que descreve o átomo como um núcleo pequeno, carregado positivamente e cercado por elétrons em órbita circular, que é denominado de:
A constituição da matéria está presente no vocabulário científico desde a Grécia antiga, mas sem comprovação científica, apenas filosófica. Como conhecimento científico os modelos atômicos foram formulados a partir de 1808 e à medida que novos e melhores métodos de investigação foram sendo desenvolvidos, evoluídos. A seguir, são apresentadas as representações gráficas de alguns modelos atômicos:
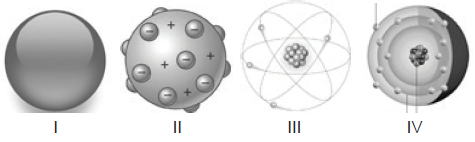
Julgue os itens a seguir:
( ) Dalton, figura I, tomou como base para o desenvolvimento de seu modelo atômico análises de conservação e proporcionalidade da massa em uma reação, originárias de Lavoisier e Proust.
( ) O modelo atômico de Thomson , figura II, apresenta a ideia de descontinuidade pela primeira vez e apresenta a primeira subpartícula atômica encontrada: o elétron.
( ) A figura III representa o modelo atômico de Rutherford, destacando o surgimento da ideia de núcleo positivo, sem os nêutrons que só seriam descobertos por Sommerfeld em 1932.
( ) A figura IV representa o átomo de Chadwick, organizando os níveis de energia eletrônicos pela primeira vez.
Assinale a alternativa que contém a análise correta em verdadeiro (V) e falso (F) para os itens apresentados.