Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
1 N2 (g) + 3 H2 (g) → 2 NH3 (g)
Dados: Massa Molar (N2 ) = 28 kg/kmol; Massa Molar (H2 ) = 2 kg/kmol. A vazão mássica de N2 na alimentação para produção de 1700 kg/dia de amônia é
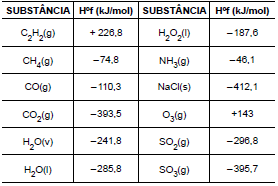
Diante do exposto, pode-se afirmar corretamente que
A Teoria do Orbital Molecular (TOM) permite prever a existência de espécies, como íons moleculares,sua estabilidade relativa e algumas propriedades. Entretanto a TOM não prevê a existência da espécie He2. Porém essa espécie existe apenas à temperatura de 4,5 K, possuindo comprimento de ligação de 52 angstrons e energia de ligação de 9,63x10-3J mol-1 determinados experimentalmente. Com base na TOM,avalie as afirmações a seguir.
Dado He (Z = 2)
I. A espécie He2 possui ordem de ligação igual a zero e é estável.
II. Ordem de ligação no íon molecular He2+é menor que no dímero de hélio
III. O comprimento de ligação do He2+é menor que do He2.
IV. As energias dos orbitais moleculares 1σg e 1σu do He2+e H2+ são as mesmas.
Assinale a alternativa que apresenta somente as afirmações CORRETAS:
Abaixo estão várias configurações eletrônicas que podem estar corretas para o átomo de nitrogênio (Z = 7). Os elétrons são representados por setas cuja direção indica o valor do número quântico spin, ms. Os três círculos para os orbitais p indicam os possíveis valores para o número quântico magnético, ml. Os estados podem ser classificados como fundamental se a configuração eletrônica representa o estado fundamental do átomo de nitrogênio, excitado se a configuração representa um possível estado excitado, ou proibido, se a configuração não pode existir.
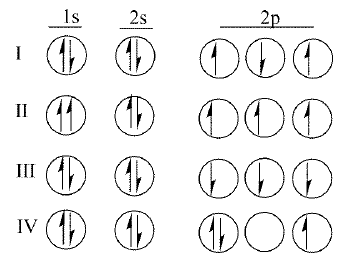
A classificação dos estados representados nas configurações de I a IV, nesta ordem, é:
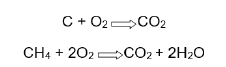
Sobre a classificação periódica dos elementos, a estrutura da classificação periódica, suas relações com a configuração eletrônica e as principais propriedades periódicas. Julgue as sentenças a seguir:
I. O elemento Boro (B, Z = 5, massa atômica = 11) é classificado como um metal alcalino.
II. Os elementos inseridos no grupo dos lantanídeos apresentam o elétron de diferenciação em um orbital .
III. O Iodo (I, Z = 53) apresenta raio atômico menor que o Cloro (Cl, Z =17).
IV. Os elementos Cálcio (Ca), Magnésio (Mg) e Rádio (Ra) são classificados como metais alcalinos terrosos.
V. A eletronegatividade diminui à medida que se aumenta o período da tabela periódica
No laboratório de Ciências o professor colocou 3 mL de água oxigenada (H2O2 ) em um tubo de ensaio, acrescentou uma pitada de um catalisador (MnO2 ) e, imediatamente, ocorreu uma efervescência, característica da liberação de um gás. Para testar o gás liberado, o professor introduziu um barbante em brasa dentro do tubo e a brasa inflamou.
A repetição do experimento com água pura, em vez de água oxigenada, não teve o mesmo resultado, isto é, a brasa ficou mais fraca e não se inflamou.
O experimento permitiu que os alunos concluíssem que o gás liberado era
Atualmente, as análises de íons importantes no sistema fisiológico humano são realizadas por métodos de Cromatografia de Troca Iônica.
Troca iônica é a permuta de íons entre uma solução contendo os íons a serem analisados e um corpo sólido insolúvel, chamado de fase estacionária. Esta fase é acondicionada em tubos de vidro ou aço inox (colunas), por onde é passada a solução contendo os íons a separar.
Considerando uma análise de plasma sanguíneo visando a separação e quantificação dos íons Ca2+ , K1+, Na1+ e Mg2+ por cromatografia líquida aquosa tendo como fase estacionária uma coluna de resina de troca catiônica, indique a ordem de eluição dos respectivos íons.
Uma indústria que fabrica suplemento mineral do tipo “fosfacálcio”, utilizado na alimentação de aves de postura, realiza processo em batelada. Ao reagir 500kg de calcário com teor de 80% em carbonato de cálcio, com solução suficiente de ácido fosfórico, produz monohidrogeno fosfato de cálcio.
A massa de sal produzida, em kg, é igual a
Após estabelecidos os postulados que definiram os modelos atômicos de Dalton a Borh, outros cientistas contribuíram com as teorias relacionadas à a natureza quântica dos elétrons nos orbitais e na eletrosfera. Dentre essas teorias, destacam-se o Princípio da Exclusão de Pauli (1), o Princípio da Incerteza de Heisenberg (2) e a Equação de Onda de Schrödinger (3).
Dentre as opções a seguir, marque a que apresenta, na respectiva ordem das teorias, os conceitos e/ou postulados corretamente relacionados.
O complexo [M(NH3)6] +3 contém um total de 126 elétrons.
Indique a opção que aponta o número atômico de M e a geometria espacial do composto de coordenação em questão.
A nitroglicerina é um líquido oleoso de cor amarelo-pálido, muito sensível ao impacto. É um dos explosivos mais fortes que existem. Sua decomposição ocorre conforme mostra a equação a seguir:

Sobre os possíveis motivos que justificam seu alto poder explosivo, foram feitas as seguintes
afirmações:
I. A energia de ligação entre os átomos de Nitrogênio, assim como entre C e O e entre H e O, são muito fortes.
II. Os produtos gasosos aumentam a pressão, consequentemente, seu poder destrutivo.
III. O aumento do grau de desordem do sistema torna a equação altamente favorável, em acordo com a segunda lei da termodinâmica.
IV. Processos endotérmicos liberam grande quantidade de energia.
O Níquel metálico reage com o ácido clorídrico conforme a reação abaixo, não balanceada:
Partindo de 17,6g de Níquel e ácido clorídrico em excesso, a massa de cloreto de níquel III e o volume
de gás Hidrogênio liberado nas CNTP serão, respectivamente,