Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
No estado fundamental de energia, o íon Cu2+ apresenta
6 elétrons em orbitais s, 12 elétrons em orbitais p e 9 elétrons
em orbitais d.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
O isótopo neutro Ba-88 possui 38 prótons e 50 nêutrons em
seu núcleo, além de 38 elétrons na região extranuclear.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
De acordo com o modelo atômico de Rutherford-Bohr, quando
aquecidos, diferentes elementos químicos geram diferentes
cores porque emitem radiação contínua.
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
Entre os elementos metálicos citados (estrôncio, magnésio
e cobre), o magnésio é o que apresenta menor energia
de ionização.
A seguir, estão listados quatro métodos empregados para a separação de misturas de CH4 e CO2.
I Absorção por água pressurizada: baseia-se na maior solubilidade em água do CO2.
II Criogenia: o resfriamento gradual da mistura faz que o componente com maior ponto de ebulição se liquefaça primeiro.
III Separação por membranas: o componente com menor diâmetro crítico apresenta maior capacidade de permeação.
IV Adsorção física seletiva do CO2 por sólidos porosos, como os carbonos ativados: a presença de grupos funcionais básicos na superfície do adsorvente (como, por exemplo, os ilustrados na estrutura abaixo) favorece o processo.
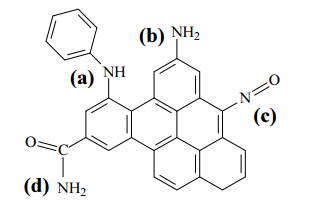
Considerando os métodos apresentados, julgue o item subsequente.
O CO2 é um óxido ácido que, ao se dissolver em água, pode com ela reagir para formar ácido carbônico, de acordo com a equação a seguir.
CO2 + H2O → H2CO3
A decomposição do carbonato de cálcio é representada por:
CaCO₃ (s) → CaO (s) + CO₂ (g)
Considerando as massas molares dos elementos carbono, oxigênio e cálcio, respectivamente, iguais a 12 g mol⁻¹,16 g mol⁻¹e 40 g mol⁻¹, julgue o item a seguir.
Na decomposição completa de 50 g de carbonato de
cálcio, obtém-se um resíduo sólido de CaO de massa
igual a 28 g.
Com relação aos conhecimentos de química inorgânica e suas aplicações, julgue o próximo item.
Na tabela periódica, os elementos estão apresentados
em ordem decrescente de volume atômico (volume
molar). Essa organização resulta em famílias de
elementos com propriedades químicas díspares
distribuídos em camadas na tabela periódica.
A Teoria do Orbital Molecular (TOM) permite prever a existência de espécies, como íons moleculares,sua estabilidade relativa e algumas propriedades. Entretanto a TOM não prevê a existência da espécie He2. Porém essa espécie existe apenas à temperatura de 4,5 K, possuindo comprimento de ligação de 52 angstrons e energia de ligação de 9,63x10-3J mol-1 determinados experimentalmente. Com base na TOM,avalie as afirmações a seguir.
Dado He (Z = 2)
I. A espécie He2 possui ordem de ligação igual a zero e é estável.
II. Ordem de ligação no íon molecular He2+é menor que no dímero de hélio
III. O comprimento de ligação do He2+é menor que do He2.
IV. As energias dos orbitais moleculares 1σg e 1σu do He2+e H2+ são as mesmas.
Assinale a alternativa que apresenta somente as afirmações CORRETAS:
Abaixo estão várias configurações eletrônicas que podem estar corretas para o átomo de nitrogênio (Z = 7). Os elétrons são representados por setas cuja direção indica o valor do número quântico spin, ms. Os três círculos para os orbitais p indicam os possíveis valores para o número quântico magnético, ml. Os estados podem ser classificados como fundamental se a configuração eletrônica representa o estado fundamental do átomo de nitrogênio, excitado se a configuração representa um possível estado excitado, ou proibido, se a configuração não pode existir.
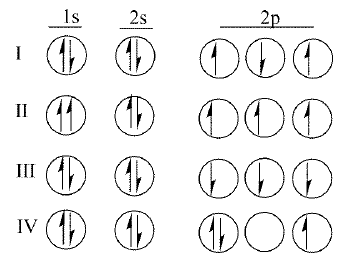
A classificação dos estados representados nas configurações de I a IV, nesta ordem, é:
Leia o fragmento a seguir.
Seleção aponta tomateiro tolerante a metal pesado
No programa de Pós-Graduação em Genética e Melhoramento de Plantas da Escola Superior de Agricultura Luiz de Queiroz (Esalq) da USP, em Piracicaba, pesquisa seleciona cultivares de tomateiro tolerantes ao metal pesado cádmio. O objetivo do estudo do engenheiro agrônomo Fernando Angelo Piotto é entender as alterações genéticas, fisiológicas e bioquímicas destas plantas provocadas pela exposição ao metal, que ajudarão a desenvolver meios de controle da contaminação.
(Agenda USP de Notícias. Disponível em: http://www.usp.br/agen/?p=105407)
Quanto à estrutura do átomo do elemento citado no texto, esse apresenta semelhanças com
Dado: Número Atômico: Cd = 48
A medicina nuclear envolve dois usos distintos de radioisótopos: terapia e diagnóstico. No uso terapêutico, a radiação é empregada na tentativa de curar doenças. Algumas formas de câncer, por exemplo, podem ser tratadas por radioterapia (...) Os radioisótopos também podem ser empregados com o propósito de diagnóstico, fornecendo informações sobre o tipo ou extensão da doença. O isótopo iodo-131 é usado para determinar o tamanho, forma e atividade da glândula tireóide. (Fonte: Química Nuclear na Medicina. http://www.qmc.ufsc.br)
A representação do iodo-131 faz referência
Todas as reações explosivas produzem grande quantidade de calor. Diz-se que são altamente exotérmicas. Grandes quantidades de calor têm um efeito impressionante de aumentar o volume dos gases– quanto mais alta a temperatura, maior o volume de gás. (...) Em reações explosivas de compostos nitrados forma-se a molécula de N2, que é estável.
(LE COUTER, P e BURRESON, J. Os Botões de Napoleão, Rio de Janeiro: Zahar, 2006)
A estabilidade dessa molécula se deve :
Leia o fragmento a seguir.
Bomba de sódio-potássio: membrana citoplasmática regula a passagem de íons
Existem substâncias que devem estar presentes, em diferentes concentrações, dentro e fora das células. Por exemplo, as células humanas mantêm uma concentração interna de íons potássio (K+) cerca de 20 a 40 vezes maior que a concentração existente no meio extracelular. Por outro lado, a concentração de íons sódio (Na+) se mantém, no interior das nossas células, cerca de 8 a 12 vezes menor que a do exterior.
(Fonte: http://educacao.uol.com.br/disciplinas/biologia/htm)
Em relação aos elementos citados no texto, assinale a afirmativa correta.
Dados: número atômico do Na = 11. / número atômico do K = 19
Trinitrato de glicerina (TNG) também denominado nitroglicerina, é o éster trinitrado do propanotriol (...) O TNG é um líquido oleoso, insolúvel em água e extremamente sensível, não apenas à temperatura, mas também ao choque mecânico, motivo pelo qual deve ser manuseado com extremo cuidado. Sua combustão ao ar gera CO2, N2, O2, H2O.
(FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010.)
A combustão completa de 1 mol de TNG (Massa molecular=227g)
produz um volume de gás carbônico nas Condições Normais de
Temperatura e Pressão de
A pólvora negra, ainda utilizada em muitos cartuchos, tem a seguinte composição aproximada : 75% salitre, 13% carvão vegetal e 12% enxofre(...) quando do disparo de arma de fogo, essa mistura termina por gerar dentre os resíduos sólidos: sulfatos (…).
(Fonte: FARIAS,R.F. Introdução à Química Forense .3ª edição. Campina, SP: Editora Átomo, 2010.)
Uma amosta de 100 gramas de pólvora negra poderá gerar uma massa, em gramas, de sulfato de sódio de, no máximo,
Dados:
massa molecular de Na2SO4 = 142u
massa atômica do S = 32 u
No laboratório de Ciências o professor colocou 3 mL de água oxigenada (H2O2 ) em um tubo de ensaio, acrescentou uma pitada de um catalisador (MnO2 ) e, imediatamente, ocorreu uma efervescência, característica da liberação de um gás. Para testar o gás liberado, o professor introduziu um barbante em brasa dentro do tubo e a brasa inflamou.
A repetição do experimento com água pura, em vez de água oxigenada, não teve o mesmo resultado, isto é, a brasa ficou mais fraca e não se inflamou.
O experimento permitiu que os alunos concluíssem que o gás liberado era