Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
O acetileno (etino) é um gás incolor, instável e altamente combustível e produz uma chama de elevada temperatura (mais de 3000°C ou 5400°F) em presença de oxigênio. Este gás tem cheiro agradável, quando puro, mas o seu odor é comumente desagradável devido às impurezas que o acompanham. O acetileno é a matéria prima na fabricação de solventes industriais, de plásticos de borracha sintética, de explosivos e na síntese de compostos orgânicos, como ácido acético e álcool etílico. A produção industrial do gás etino está representada, abaixo, em três etapas, conforme as equações balanceadas:
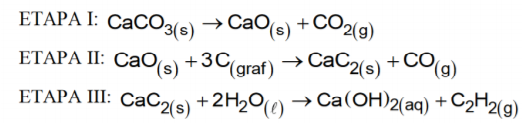
Considerando-se as etapas citadas e admitindo-se que o rendimento de cada etapa da obtenção do gás etino, por esse método, é de 100%, a massa de carbonato de cálcio, necessária para produzir 10,4g do gás etino (C2H2), é
Dados:
H = 1u, C =12u, O = 16u, Ca = 40u.
Foi realizada uma aula experimental visando a síntese de uma amida aromática, a acetanilida (ou N-fenil-acetamida), de acordo com o procedimento experimental resumidamente descrito a seguir:
Em um béquer limpo e seco, misturar o ácido acético glacial e o acetato de sódio anidro. Adicionar a anilina e, em seguida, o anidrido acético. Após 10 minutos de reação, verter o meio reacional sobre água destilada gelada, sob agitação. A acetanilida precipita. Filtrar em funil de Büchner e lavar o produto bruto com água destilada gelada até pH neutro. Purificar a acetanilida por recristalização usando água quente e carvão ativado.
Sobre esse procedimento, considere as seguintes afirmativas:
1. A reação envolvida na síntese da acetanilida é uma reação de acilação.
2. Foi utilizada água gelada na etapa de precipitação da acetanilida bruta para reduzir as perdas de produto por solubilidade em água.
3. A purificação do produto bruto foi realizada em água quente porque a acetanilida é mais solúvel em água quente que em água fria.
4. O carvão ativado foi utilizado para acelerar a precipitação da acetanilida.
Assinale a alternativa correta.
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram colocadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?
A queima de enxofre elementar gera compostos gasosos responsáveis pela formação da chuva ácida, com consequente deterioração de edificações e de monumentos construídos em mármore, acompanhada de liberação de gás carbônico na atmosfera. Esse processo pode ser ilustrado pelas seguintes reações não balanceadas:
S + O2 → SO2
SO2 + O2 → SO3
SO3 + H2O → H2SO4
H2SO4 + CaCO3 → CaSO4 + H2CO3
H2CO3 → CO2 + H2O
Considerando essa sequência de eventos, assinale a alternativa que apresenta a equação global balanceada dos eventos
supracitados.
Na determinação de cálcio em águas naturais, a AOAC (Association of Official Analytical Chemists/USA) recomenda um método gravimétrico que consiste em adicionar excesso de ácido oxálico (C2H2O4) a um volume conhecido de amostra e, em seguida, adicionar a quantidade necessária de NH4OH. O precipitado obtido é filtrado, seco, calcinado e pesado, e a massa de CaO obtida é utilizada para calcular a quantidade de Ca na amostra que, segundo a norma da AOAC, deve ser expressa como teor de carbonato de cálcio. O método citado é ilustrado pelas equações a seguir. Na análise de uma amostra de 100,00 mL de água, a massa de CaO obtida foi de 0,2800 g.
Ca+2(aq.) + C2O4 -2 (aq.) → CaC2O4(s)
CaC2O4(s) → CaO(s) + CO + CO2
Dados: Massas molares aproximadas: MM(C2H2O4.2H2O) = 126 g/mol; MM(CaO) = 56 g/mol; MM(CO2) = 44 g/mol, MM(CaCO3) = 100 g/mol; densidade (H2O) = 1,0 kg/L.
De acordo com os dados apresentados, qual é a concentração de cálcio na amostra de água analisada, expressa em ppm
de CaCO3?
Alcanos podem ser obtidos em laboratório, pela reação de haletos de alquila em presença de sódio metálico (síntese de Wurtz), como indicado no esquema reacional abaixo:
2R-X + Na → R-R + NaX
Com base nesse esquema, assinale a alternativa que apresenta os possíveis produtos orgânicos da reação do 2-clorobutano
com o 3-cloro-pentano nas condições da síntese de Wurtz.
A massa atômica relativa dos elementos é obtida pela determinação da média ponderada de seus isótopos. Dentre os elementos do grupo 14 da tabela periódica, mostrados abaixo, o que apresenta maior incerteza na sua massa atômica relativa é o
Elemento: C; Si; Ge; Sn; Pb
Massa Atômica relativa (u): 12,011; 28,086; 72,61(2); 118,71; 207,2
Pode-se considerar que o processo Rasching de produção de hidrazina (N2H4), que envolve a oxidação de amônia, ocorre em três etapas consecutivas, representadas pelas equações químicas não balanceadas na sequência abaixo:
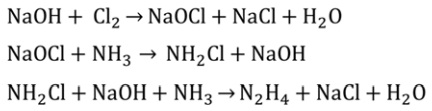
Assim, o número de mol de amônia necessários para a produção de dois mol de hidrazina é
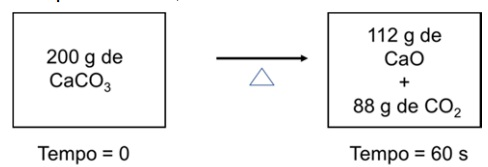
O acúmulo total de massa, em gramas, para a decomposição térmica do carbonato de cálcio em um sistema fechado, representado pelo esquema abaixo, é
O Diagrama de Orbitais Moleculares (DOM) para o íon molecular H2 + pode ser obtido pela Combinação Linear de Orbitais Atômicos (CLOA) das funções de onda normalizadas que designam o orbital s de um átomo de hidrogênio a, representado como 1sa, com a função onda normalizada do átomo de hidrogênio b, representado como 1sb. Essas combinações lineares estão mostradas abaixo:

A ordem de ligação em H2 + é
Dado: 1H = 1s1.
A constante de equilíbrio para a dissociação de um mol ácido monoprótico em 1 litro de água é aproximadamente 1x10-5 à temperatura de 25 ºC. Se a pressão é constante, o valor aproximado da variação na energia de Gibbs (kJ mol-1) para essa reação é de
DADOS:
Constante dos gases ideais = 8,31 J K-1 mol-1 Log10 e = 0,434
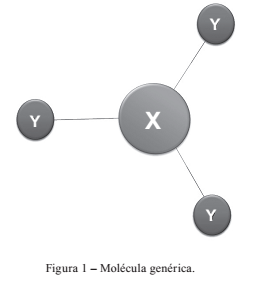
Considerando a molécula genérica a seguir, indique quantos modos fundamentais de vibração no infravermelho essa molécula pode apresentar: