Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
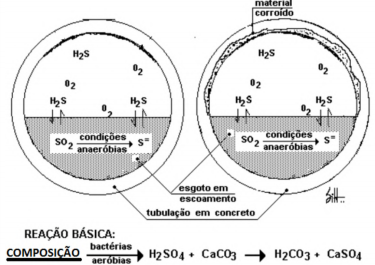
Avalie a figura a seguir e, tendo como base o tema “Corrosão bacteriana do concreto nas canalizações dos esgotos sanitários”, assinale a alternativa que substitua o termo grifado COMPOSIÇÃO na fórmula.
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?
Os PCBs (policlorobifenil) foram extensivamente utilizados como materiais dielétricos e fluidos refrigerantes em transformadores, capacitores e motores elétricos, devido aos altos valores de capacidade calorífica e temperatura de ebulição. No entanto, os PCBs possuem alta toxicidade. O 3,3’,4,4’-tetraclorobifenil é um PCB bastante comum.
Dados: Cp, 298K: água = 4,18 J.g-1K-1 ; 3,3’,4,4’-tetraclorobifenil = 311 J.mol-1K-1 . M (g.mol-1 ): água = 18; 3,3’,4,4’- tetraclorobifenil = 292. Teb, 1atm (°C): água = 100; 3,3’,4,4’-tetraclorobifenil = 380.
Considerando a mesma quantidade de matéria entre a água e o 3,3’,4,4’-tetraclorobifenil, a variação de temperatura (em ºC) no PCB ao receber a quantidade de calor que provoca uma variação de temperatura de 80 °C na água é de:
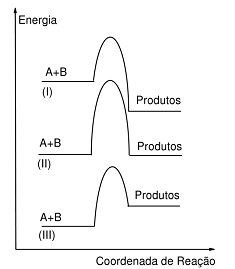
Na figura ao lado estão ilustrados gráficos da variação de energia no decorrer da reação para três sistemas independentes: (I), (II) e (III). A e B são espécies distintas em cada caso.
Acerca do exposto, considere as afirmativas a seguir:
1. No caso (I), o excesso de energia é transferido para a vizinhança.
2. A curva (II) corresponde a uma reação isoergônica.
3. A reação (II) necessita da maior energia de ativação dos três casos.
4. A reação (III) pode ocorrer a temperatura ambiente.
Assinale a alternativa correta.
A constituição da matéria sempre intrigou o homem. Ao longo da história, diversos modelos para explicar a matéria foram propostos. Esses modelos, na maioria, receberam os nomes dos seus proponentes. A respeito do tema, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
1. Átomo de Dalton.
2. Átomo de Rutherford.
3. Átomo de Bohr.
4. Átomo mecânico-quântico.
( ) Partícula constituída por um núcleo, contendo prótons e nêutrons, rodeado por elétrons descritos por funções orbitais.
( ) Partícula constituída por um núcleo, contendo prótons e nêutrons, rodeado por elétrons que circundam em órbitas estacionárias.
( ) Partícula indivisível e indestrutível, mesmo durante as transformações químicas.
( ) Partícula que possui um núcleo central dotado de cargas elétricas positivas, sendo envolvido por uma nuvem de cargas elétricas negativas.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
A tabela periódica é dividida em grupos e períodos. As propriedades periódicas dos elementos são determinadas pela estrutura eletrônica do átomo. Sobre o assunto, considere as seguintes afirmativas:
1. O raio atômico num grupo de um metal de transição praticamente não varia entre átomos do quinto e sexto períodos.
2. A primeira energia de ionização de um átomo é maior que sua segunda energia de ionização.
3. A afinidade eletrônica do F (Z = 9) é maior que do Ne (Z = 10).
4. A eletronegatividade de um átomo do grupo II é menor que a de um átomo do grupo XV.
Assinale a alternativa correta.
Num experimento químico eram necessários 60 gramas de iodeto de cobre (I), mas este reagente estava em falta. Assim a solução do problema era fabricá-lo de acordo com a reação química a seguir:
KI(aq) + CuSO4(aq) → I2(s) + K2SO4(aq) + CuI(s)
Quantos gramas de sulfato de cobre (II) serão necessários para formar a quantidade exata de iodeto
de cobre (I)?
Joãozinho cursa a terceira série do ensino médio e está indeciso em escolher para qual curso iria prestar o vestibular. Sua escola solicitou uma visita para a turma de Joãozinho aos laboratórios da Universidade de Rio Verde para ajudar na escolha da futura profissão. Numa das demonstrações no Laboratório de Química, eles observaram o seguinte experimento:
O professor químico colocou uma pitada de permanganato de potássio num vidro de relógio, acrescentou algumas gotas de acido sulfúrico concentrado e misturou com um bastão de vidro. Em seguida, o professor tocou, com a ponta do bastão de vidro impregnada com a mistura, um algodão embebido com etanol. Imediatamente o algodão pegou fogo.
Quando Joãozinho retornou para a escola, o professor fez o seguinte questionamento: ao invés de utilizar uma mistura sólida de permanganato de potássio com ácido sulfúrico fosse usada uma solução das mesmas substâncias e o etanol fosse adicionado diretamente nesta solução, qual o produto orgânico obtido no final? E qual o tipo de reação?
No processo de obtenção de ferro a partir da hematita, Fe2O3 (s), considere a equação não balanceada:
Fe2O3 (s) + C (s) → Fe (s) + CO (g)
Utilizando-se 4,8 t de minério e admitindo-se um rendimento de 70% na reação, a quantidade de ferro produzida será de:
Dados: Fe = 56; O= 16; C= 12 (valores expressos em g/mol)
O hipoclorito de sódio, conhecido popularmente como água sanitária, tem propriedades bactericida e alvejante. Para sua fabricação, reage-se gás cloro com soda cáustica:
Cl2 (g) + 2 NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (l)
A massa de NaOH (aq) necessária para obter 298 kg de hipoclorito de sódio é:
Dados: H = 1; O = 16; Na = 23; Cl = 35,5 (valores expressos em g/mol)
O ferro metálico pode ser obtido industrialmente por meio da seguinte reação não balanceada:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Considerando uma reação com transformação
total de produtos em reagentes, assinale a
alternativa correta sobre esse processo.
O carbureto (carbeto de cálcio) é um sólido empregado tanto para iluminação quanto para processos de solda, devido à formação de acetileno (C2H2), quando da sua exposição à água, de acordo com a equação não balanceada:
CaC2(s) + H2O(l) → Ca(OH)2(aq) + C2H2(g)
Uma amostra de 10g de um sólido contendo 40,0% de carbeto de cálcio foi colocada em 200g de água, produzindo acetileno. Considere que as impurezas são imiscíveis em água e não interferem na produção de acetileno e que, na reação, todo o carbureto foi convertido em acetileno. Com base no exposto, a quantidade mais próxima de acetileno produzida e o pH do meio aquoso após a reação serão: Dados:massas molares: H: 1g/mol; C: 12g/mol; O: 16g/mol; Ca:40g/mol
solubilidade do Ca(OH)2(aq) = 1,2g/L
Uma determinada estação de tratamento faz a desinfecção de água residual com HOCl e, após o processo, determinou-se que o teor total de HClO restante (expresso como Cl2) é de 2 mg L-1. Antes da liberação desta água para o ambiente, é necessário eliminar-se o excesso de HClO, o que é feito reduzindo-o a cloreto pela adição de uma solução de bissulfito de sódio (NaHSO3) 0,1 mol L-1. Se o fluxo de água residual a ser tratada é de 2 m3 s-1, a taxa da solução de bissulfito de sódio (em L s-1) que deve ser adicionada ao fluxo de água residual para uma completa inativação do cloro é de aproximadamente
Observação:
Considere que o fluxo da solução de NaHSO3 é desprezível em relação ao fluxo da estação.
Dados:
Massa molar (g mol-1): NaHSO3 = 104; Cl2 = 71; HOCl = 52,5.
Cl2 + 2H2O → 2HOCl + 2H+ + 2e-
2HSO3- + 2HOCl → 2SO42- + 2Cl- + 4H+
Assinale a alternativa que apresenta um produto da seguinte reação orgânica.