Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
Uma das matérias primas utilizadas na fabricação do cimento é o óxido de cálcio, também conhecido como cal virgem. Esse óxido pode ser obtido a partir da reação de decomposição do carbonato de cálcio, conforme mostra a equação abaixo:
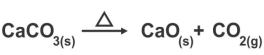
Quantos gramas de óxido de cálcio podem ser obtidos a partir da decomposição de 300 g de
carbonato de cálcio?
56,0 g de nitrogênio gasoso foram inseridos em um pneu, a 25 °C. Considerando que a capacidade do pneu é de 10,0 litros, a pressão atingida pelo gás nesse pneu, em atmosferas, a essa temperatura, foi de, aproximadamente,
Dado:
Constante universal dos gases = 0,082 atm.L.mol−1 . K−1
O modelo para o átomo proposto por Thomson está representado abaixo.
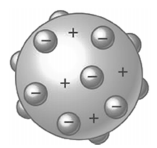
(http://www.explicatorium.com/images/modelo-Thomson.jpg. Acesso em 03/01/2016)
Com esse modelo, Thomson interpretou
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Nas CATP, o volume ocupado pelo N2(g), em litros, quando reage 1 mol de nitroglicerina é igual a
Dado:
Volume molar de qualquer gás, nas CATP = 25,0 L
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Gráficos de energia potencial para a formação de moléculas ou íons moleculares são bastante úteis, pois podem ser utilizados para a obtenção de parâmetros importantes como distância de ligação (DL) e energia de ligação. Observe o gráfico a seguir.
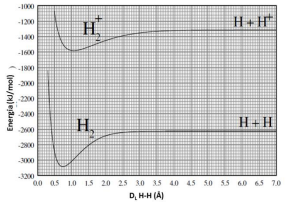
A partir das informações que podem ser extraídas do gráfico, é CORRETO afirmar que:
A utilização de um determinado elemento químico requer o conhecimento de suas propriedades. Para materiais condutores, por exemplo, são utilizados elementos metálicos, os quais podem ser moldados na forma de fios. As propriedades dos elementos, entre elas a condutividade, estão ligadas à sua configuração eletrônica de valência, que, por sua vez, pode ser obtida a partir dos valores sucessivos de energia de ionização (E.I). A partir da configuração eletrônica de valência, pode-se determinar a qual grupo da tabela periódica um elemento representativo pertence. Uma grande variação relativa do valor da E.I indica que o elétron é retirado de uma camada mais interna e os anteriores, consequentemente, da camada de valência. Observe os Quadros 1 e 2.
O elemento genérico adequado para obtenção de um fio condutor é:
Uma das formas de produção da amônia é a partir da reação entre a cal viva (óxido de cálcio) e o cloreto de amônio, conforme reação a seguir:
CaO(s) + 2 NH4Cl(s) → 2 NH3(g) + H2O(g) + CaCl2(s)
10 g de uma amostra de cal viva foram colocados para reagir com excesso de cloreto de amônio e foram produzidos 5 g de amônia. Qual a porcentagem de óxido de cálcio dessa amostra de cal viva?
Dados: CaO (56 g mol-1 )
NH4Cl (53,5 g mol-1 )
NH3 (17 g mol-1 )
H2O (18 g mol-1 )
CaCl2 (111 g mol-1
)
O cloreto de titânio(IV), TiCl4, é um importante produto químico industrial. Esse pode ser usado tanto na obtenção do TiO2 quanto de titânio metálico. O TiCl4 pode ser obtido a partir de um minério contendo titânio (TiO2 impuro), utilizado em excesso, com carbono e gás cloro, conforme a equação química a seguir.
TiO2(s) + 2 Cl2(g) + C(s) → TiCl4(l) + CO2(g)
Considere que a obtenção do TiCl4 seja feita a partir de 852 g de C e 852 g de Cl2.
Dados: Cl2 (71 g mol-1 ); C (12 g mol-1 ) e TiCl4 (190 g mol-1 )
O reagente limitante e a massa em gramas de TiCl4 obtida são, respectivamente: