Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
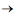 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
De acordo com os dados apresentados, o metal alcalino que estabelecerá com o flúor a ligação química de maior caráter iônico será o
A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
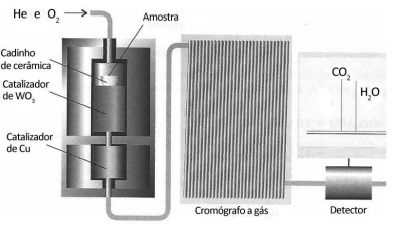
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
I. Apresentam densidade elevada comparados com os metais, equivalente a 4,0 g/cm3 .
II. Apresentam elevados níveis de reatividade.
III. São bioacumulados.
IV. Organismos vivos podem degradá-los.
V. Possuem elevado número atômico.
Assinale a alternativa correta.
I. CaCO3 → CaO + CO2 II. C + O2 →CO2 III. 2NaI + Cl2 → 2NaCl + I2 IV. 2AgCl → 2Ag + Cl2 V. Fe + CuSO4 →FeSO4 + Cu
Assinale a alternativa correta:
O diagrama de níveis de energia da molécula F2 está ilustrado a seguir. Os OM’s foram numerados segundo a ordem crescente de suas energias; as linhas tracejadas indicam a origem de cada um.
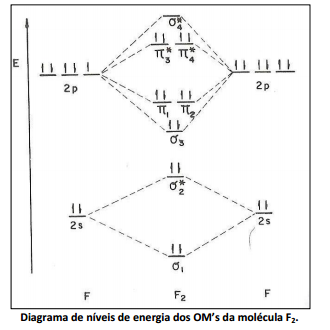
Com relação ao diagrama de níveis de energia dos OM’s da molécula F2 analise as afirmativas a seguir.
I. A expressão algébrica para combinação δ3 = 2pz – 2pz.
II. Aplicando‐se o princípio da edificação à molécula F2 obtém‐se a configuração eletrônica KK (δ1) 2 (δ2 * ) 2 (δ3) 2 (π1) 2 (π2) 2 (π3 * ) 2 (π4 * ) 2 . KK indica os elétrons internos, do nível quântico n = 1.
III. OL é igual a 2.
Está(ão) correta(s) apenas a(s) afirmativa(s)
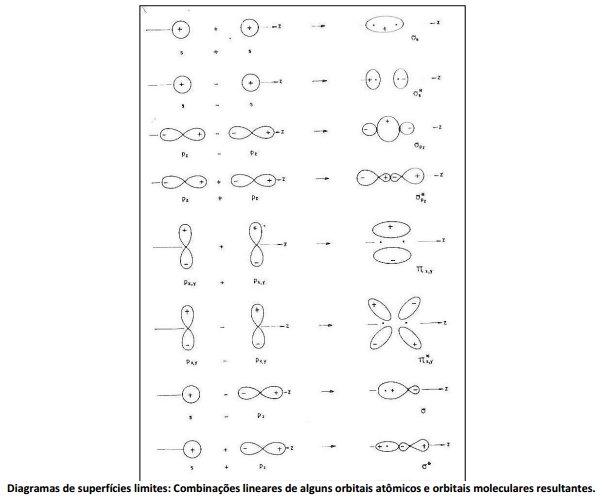
Sobre a figura, analise as afirmativas a seguir. I. As regiões nodais já existentes nos OA’s persistem nos OM’s. II. Toda vez que há uma região nodal, a função de ondas não muda de sinal. III. Qualquer orbital molecular antiligante possui um plano nodal perpendicular ao eixo internuclear e situado entre os núcleos. Está(ão) correta(s) apenas a(s) afirmativa(s)
A sequência está correta em
( ) No modelo da TCC, a interação eletrostática metal‐ligante remove parcialmente a degeneração dos cinco orbitais d que existem no íon metálico isolado. ( ) Os ligantes são considerados cargas ou dipolos pontuais. A sequência está correta em