Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.981 questões
Coloração típica de chamas devido à presença de alguns cátions em estado excitado
Elemento Cor da chama Elemento Cor da chama
Antimônio Azul-esverdeada Cobre Verde
Arsênio Azul Estrôncio Vermelho-tijolo
Bário Verde-amarelada Lítio Carmin
Cálcio Alaranjada Potássio Violeta
Chumbo Azul Sódio Amarela
Analise a reação a seguir.
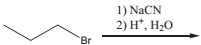
Assinale a alternativa que indique o produto principal que ela
fornece.
A indicação da presença de mercúrio em solução pode ser obtida pela observação da formação de precipitado por meio da utilização de soluções de:
I. cromato de potássio
II. ácido clorídrico
III. hidróxido de sódio
IV. nitrato de sódio
Assinale:
Uma amostra de uma substância desconhecida A reagiu com uma solução de ácido clorídrico concentrado. Durante a reação foi observada a evolução de um gás que, ao borbulhar em uma solução de cloreto de bário forneceu um precipitado B. A solução resultante da reação A + HCl, ao ser gotejada sobre uma solução de sulfato de sódio, forneceu, por sua vez, um precipitado C.
O ensaio indica que os compostos A, B e C podem ser, respectivamente:
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Na produção do sódio metálico, é possível realizar a eletrólise do NaCl na forma sólida.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A partir da localização do N a e do K na tabela periódica, é correto concluir que a eletrólise do KC1 requer a aplicação de um potencial elétrico maior que aquele requerido para a eletrólise do NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
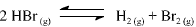
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O volume de solução estoque em pregada para a preparação da
solução desejada foi superior a 8,0 mL.
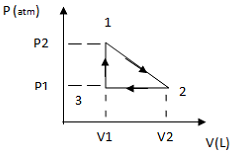
Fonte: FUNCERN, 2015
Com base nas informações do gráfico,
X: 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d10
Y: 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d10, 4p6 , 5s2 , 4d10, 5p6 , 6s1
Z: 1s2 , 2s2 , 2p6 , 3s2 , 3p5
W: 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d10, 4p6 , 5s1
Com relação às propriedades dos átomos,
Os laboratórios de química, de modo geral, são lugares perigosos, principalmente para seus usuários, devido à grande quantidade e diversidade de substâncias químicas neles existentes. A respeito dos cuidados que devem ser adotados nos laboratórios de química, julgue o item que se segue.
O vazamento de amônia pode ser detectado utilizando-se ácido
clorídrico concentrado.
Os laboratórios de química, de modo geral, são lugares perigosos, principalmente para seus usuários, devido à grande quantidade e diversidade de substâncias químicas neles existentes. A respeito dos cuidados que devem ser adotados nos laboratórios de química, julgue o item que se segue.
A chama que surge em decorrência de acidente com sódio
metálico deve ser apagada com água.
No sistema heterogêneo que constitui o solo, os compostos orgânicos, de modo geral, sofrem modificações de naturezas química, física e biológica, causadas pelos processos de transformação, retenção e transporte; todos esses processos, em maior ou menor escala, podem causar a contaminação da área.
Tendo como referência essas informações, julgue o item seguinte.
No processo de transformação, ocorre degradação química e
biológica.
O propeno é muito utilizado, também, na produção do cumeno, por meio da alquilação Friedel-Crafts do benzeno catalisada por HF. A representação dessa reação é mostrada no esquema a seguir.

Com respeito às alquilações Friedel-Crafts e às espécies envolvidas nessas reações, julgue o item que se segue.
De todos os haletos de hidrogênio, o HF é o mais ácido. Esse
comportamento pode ser explicado com base na
eletronegatividade do átomo de flúor, o que estabiliza a base
conjugada do ácido.
As reações de hidroformilação são catalisadas por complexos de metais de transição, sendo os complexos de ródio (Rh) os mais ativos. Quando se deseja isolar o aldeído, um dos precursores catalíticos mais empregados é o RhH(CO)(PPh3)3, no qual PPh3 representa uma molécula de trifenilfosfina (três grupos fenil ligados a um átomo de fósforo). Por outro lado, o emprego do catalisador Rh(cp)(CO)2(PBu3), por exemplo, tem permitido a obtenção direta de álcoois.

Considerando ΔT como o parâmetro de desdobramento do campo cristalino e que a geometria do complexo Rh(cp)(CO)2(PBu3),apresentada, seja tetraédrica, julgue o item subsequente.
De acordo com a teoria das ligações de valência, o complexo RhH(CO)(PPh3)3 é paramagnético, ou seja, apresenta pelo menos um elétron desemparelhado.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
Se 1 mmol de ácido arsênico, H3AsO4, for adicionado a 100 mL de solução contendo 3 mmol de iodeto de potássio, a cor vermelho-alaranjada aparecerá quase que imediatamente.