Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.981 questões
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
Considerando a reação H3AsO3 + I-3 ↔ H3AsO4 + 3I- + 2H+ , é correto afirmar que, ao se adicionar 1 mmol de ácido arsenioso, H3AsO3, a 100 mL de uma solução, contendo 1 mmol de íon triiodeto, a solução produzida será incolor.
Considerando os riscos da exposição humana a substâncias tóxicas, julgue o item seguinte.
Em crianças, a exposição a chumbo pode causar
comprometimento neurológico, inclusive com diminuição do
coeficiente de inteligência; em adultos, a exposição pode
causar aumento da pressão arterial.
2KNO3(s) + S(s) + 3C(s) → K2S(s) + N2(g) + 3CO2(g)
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O → NO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
A introdução de átomo de halogênio no anel aromático do esqueleto básico de substâncias ilícitas se tornou uma importante ferramenta para a obtenção de novas drogas sintéticas, o que deixou o mercado ilegal dessas substâncias um passo a frente da legislação que controla o tráfico de drogas. Considerando essas informações e as figuras I e II, acima, que representam, respectivamente, estruturas químicas de algumas drogas sintéticas comuns e as dessas mesmas drogas, na forma halogenada, julgue o item que se segue.
O tratamento de aminobenzeno com ácido nitroso e ácido tetrafluorobórico, seguido de aquecimento, leva à formação de fluorbenzeno,
e nitrogênio molecular.
A introdução de átomo de halogênio no anel aromático do esqueleto básico de substâncias ilícitas se tornou uma importante ferramenta para a obtenção de novas drogas sintéticas, o que deixou o mercado ilegal dessas substâncias um passo a frente da legislação que controla o tráfico de drogas. Considerando essas informações e as figuras I e II, acima, que representam, respectivamente, estruturas químicas de algumas drogas sintéticas comuns e as dessas mesmas drogas, na forma halogenada, julgue o item que se segue.
4-BMC é o produto regioisomérico majoritário da reação entre efedrona e bromo molecular na presença de tribrometo de ferro.
A reação química entre 2,5-DMA com formaldeído e ácido fórmico tem como produto uma substância química com fórmula molecular C12H19NO2.
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
A redução do nitrato, que consome três moles de elétrons por mol de NO3 – em meio ácido, gera o óxido nítrico, que é um agente complexante mais forte que o íon nitrato
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
Se o gás carbônico reagir com a água para formar o ácido carbônico, o CO2 receberá um par de elétrons da água, que é uma base de Lewis.
2KNO3(s) + S(s) + 3C(s)-> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O -> 6 HNO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um
composto empregado como fonte de óxido nítrico — um potente
vasodilatador — administrado por via intravenosa em pacientes em
situação de emergência hipertensiva. O uso inadequado desse
medicamento, que é sensível à luz e que produz cianeto em sua
decomposição, pode causar morte acidental por déficit de oxigênio
no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Considere que esse complexo é octaédrico e de spin baixo.
Nesse caso, é correto afirmar que existem três elétrons
desemparelhados nos orbitais dxy, dyz e dxz do metal e que há
dois possíveis isômeros para esse complexo
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um
composto empregado como fonte de óxido nítrico — um potente
vasodilatador — administrado por via intravenosa em pacientes em
situação de emergência hipertensiva. O uso inadequado desse
medicamento, que é sensível à luz e que produz cianeto em sua
decomposição, pode causar morte acidental por déficit de oxigênio
no organismo.
Com base nas informações apresentadas, julgue o próximo item.
De acordo com a teoria do campo ligante, pelo menos três elétrons ocupam os orbitais t2g não ligantes.
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
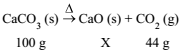
A massa, em gramas, correspondente a X é igual a
Considere as seguintes representações para átomos: 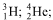
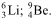 O número de nêutrons de cada átomo é, respectivamente,
O número de nêutrons de cada átomo é, respectivamente,
Este relato é um histórico importante sobre o elemento ferro, que pode ser obtido através da hematita (óxido férrico). Para a formação da hematita ocorre uma reação entre ferro metálico e gás oxigênio. Considerando este processo químico, quantas gramas de hematita, podem ser obtidas quando 20 mols de ferro reagem com quantidade suficiente de oxigênio? Assinale a alternativa CORRETA.
Em um laboratório de química analítica, um estudante encontrou um frasco com uma solução contendo, o seguinte rótulo: “cátion do grupo IV”. Para rotular corretamente, o aluno realizou alguns testes com alguns reagentes comuns para identificação de cátions do grupo IV e fez as seguintes observações:
1º) Ao fazer o teste utilizando solução de amônia, nenhum precipitado foi observado;
2º) Empregando uma solução de carbonato de amônio, um precipitado de cor branca foi formado, sendo este solúvel em ácidos minerais diluídos;
3º) Após utilizar ácido sulfúrico diluído, ocorreu a precipitação de um sólido branco, pesado e finamente dividido, que foi praticamente insolúvel em água.
Com base nos testes e observações do
estudante, o cátion presente no frasco mal
rotulado é?
( ) Dalton afirmava que os átomos são permanentes e indivisíveis e que as transformações químicas consistem em uma separação, combinação ou rearranjo de átomos. Sua teoria contribuiu para explicação da conservação das massas em uma reação química.
( ) Após lançar o modelo de “pudim de ameixas" o físico inglês J. J. Thomson, anos mais tarde, postulou que os elétrons, carregados negativamente, estavam arranjados em anéis e circundavam completamente em órbitas a esfera positiva.
( ) Rutherford apresentou um modelo de átomo que possuía um pequeno núcleo rodeado por um grande volume no qual os elétrons estão distribuídos. O núcleo carrega toda a carga positiva e também toda massa do átomo.
( ) Bohr desenvolveu um modelo atômico no qual postulou a existência de níveis de energia eletrônica quantizada. O mesmo atentou para o fato de que os elementos exibem um espectro de linhas.
Assinale a seguir a alternativa CORRETA, na sequência de cima para baixo:
