Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.981 questões
Na figura abaixo, podemos observar o ponto de ebulição dos elementos da família 16 da tabela periódica, ligados ao hidrogênio. Um comportamento excepcional da água é notado, comparando-se seu ponto de ebulição com o das substâncias moleculares do restante do grupo.
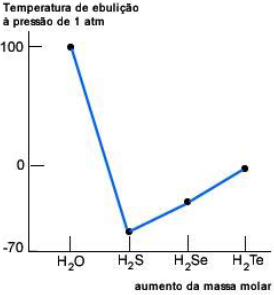
De acordo com a análise do gráfico acima, é CORRETO afirmar:
NaHCO3 + HCl → NaCl + H2O + CO2
Podemos afirmar que o grau de pureza da amostra de bicarbonato de sódio é
A reação química em um bastão de luz ou pulseiras, em geral, envolve várias etapas diferentes. Um bastão de luz comercial é feito de uma solução de peróxido de hidrogênio e de uma solução contendo éster de fenil oxalato e um corante fluorescente. Acompanhe a sequência de acontecimentos quando as duas soluções são combinadas:
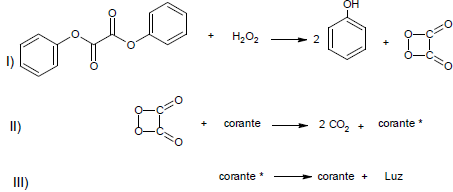
Considere as afirmativas abaixo:
I - O peróxido de hidrogênio oxida o éster de fenil oxalato, resultando em uma substância química chamada fenol e um éster de peroxiácido instável.
II - O composto de peróxi-cíclico se decompõe em dióxido de carbono; essa decomposição libera energia para o corante.
III - Os prótons dos átomos do corante migram para um nível mais alto, e depois retornam liberando energia na forma de luz.
ão CORRETOS:
“Cerca de 60% do nosso corpo é composto por água. Esse líquido precioso é fundamental para manter o sangue em circulação, controlar a temperatura e permitir inúmeras reações químicas que ocorrem a todo instante no organismo. Em dias normais, perdemos aproximadamente 2,5 litros de água pela respiração, pela urina, pelo suor e, em menor escala, pelas fezes. Claro que no verão ou após uma atividade física intensa, a perda pode ser maior.” Indique a alternativa que apresenta o número de átomos de oxigênio que são perdidos pela respiração, de acordo com o texto acima.
Dados: massas atômicas: H = 1 u; O = 16 u; N =; dágua = 1,0 g/mL 6,0 x 1023
A variação das abundâncias dos isótopos estáveis é ocasionada por processos físicos de mudança de fase, como evaporação e condensação.
Tratando-se 0,5 kg de nitrato de potássio pelo ácido sulfúrico, a quente, ocorre a formação de sulfato de potássio e ácido nítrico. Sabendo-se que o rendimento da reação é de 90%, a massa (em gramas) de ácido nítrico obtida é de:
Dados: K=39; N=14; S=32