Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.981 questões
Dado: massa molar do Al =27g.mol -1
Dados:
constante de Rydberg (R)= 2,18.10-18 J,
constante de Planck (h)= 6,67.10-34 J.s, velocidade da luz (c)= 3,00.108 m.s-1
I- Os elementos do grupo VII A ou 17 da Tabela Periódica são os mais eletronegativos de seus períodos.
II- A diferença de eletronegatividade entre o Hidrogênio e o Enxofre é suficiente para estabelecer em ligações iônicas.
III-A eletronegatividade dos ametais diminui quando o número relativo a sua camada de valência aumenta.
IV-Os metais cuja camada de valência apresenta configuração s1 são os de menor eletronegatividade de seus períodos.
Estão corretas:
I- Óxidos neutros não reagem com a água.
II- ONa2O reage com ácido formando sal e água.
III-O óxido Cl2O3 pode reagir para formar ácido.
IV-Os óxidos ácidos apresentam ligações covalentes.
Estãocorretas:
O volume, em litros, obtido do produto quando são consumidas 2,71x1024moléculas de Hidrogênio, nas CNTP, é igual a:
I- Zn+2HCl→ H2+ZnCl2
II- 2NaBr+Cl2 → 2NaCl+Br2
III- Ca+FeSO4 → Fe+CaSO4
IV- Al+3HCl→ 3/2H2+AlCl3
V- 2KF+Cl2 → 2KCl+F2
Em função da reatividade dos metais e dos halogênios, podemosafirmarqueocorremasreações:
I- metal alcalino-terroso
II- em sais pode ter número de oxidação-1
III- em sais pode ter número de oxidação+7
IV- sua configuração eletrônica termina com s1
Os seguintes elementos correspondem respectivamente às informações I a IV:
 , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
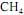 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 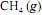 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Se o consumo mensal de energia elétrica da referida empresa for de 1,0 × 1012 J, a combustão do
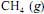 , sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
, sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de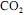 para suprir as necessidades mensais de energia da empresa.
para suprir as necessidades mensais de energia da empresa. I. Oxigênio: gás indispensável para a sobrevivência dos seres vivos. Ele reage com certas substancias presentes no corpo dos seres vivos e produz água, energia e gás carbônico. A energia produzida nessa reação é responsável pela manutenção da vida de todo os seres;
II. Nitrogênio: é vital para as plantas, as mesmas absorvem o gás carbônico e eliminam oxigênio, tal processo é conhecido como fotossíntese;
III. Gases raros: não são aproveitados pelo nosso organismo, mas são utilizados em outras tarefas que são de grande proveito para o ser humano, por exemplo, o argônio – utilizado em lâmpadas incandescentes.
Está(ão) correto(s) o(s) item(ns):
Esse gás consiste em