Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.981 questões
[Kr] 4d15s2.
A localização desse elemento químico na tabela periódica dos elementos e a sua classificação são, respectivamente,
Tc Ru Pd2+ Ag+ Cd2+
Dentre esses átomos, possuem a mesma quantidade de elétrons o:
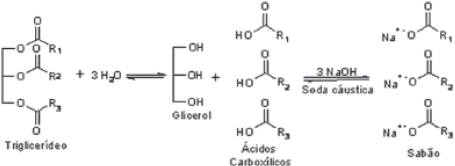
Principais exemplos de Biocombustíveis
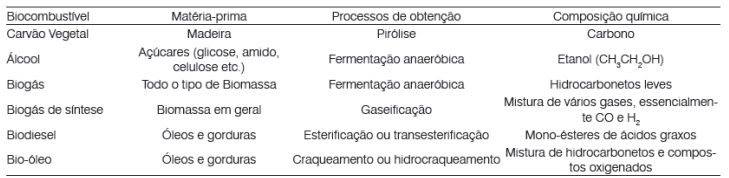
(Química Nova na Escola, n28, maio, 2008.)
Considere um gás ideal que passa por uma transformação durante a qual sua pressão e o volume que ocupa podem variar, mas sua temperatura é sempre mantida constante. A Lei de Boyle-Mariotte garante que, nessas circunstâncias, o produto entre a pressão P e o volume V ocupado pelo gás é constante. Quando o gás considerado ocupa o volume correspondente a 18ml, a sua pressão é de 3 atm (atmosferas).
Se a medida do volume ocupado pelo gás for de 2,25ml, então, sua pressão, em atmosferas, medirá
Dados: C: 12 g/mol; H: 1 g/mol. Considere que o gás metano tenha comportamento ideal. R: 0,082 atm.L.mol-1.K-1.
A pressão no interior do recipiente é:
Da reação química entre os compostos dos frascos 1 e 2 origina-se o sulfato de cálcio.
A fórmula molecular H12C4O3 apresenta como fórmula mínima e fórmula percentual H4C2O1 e H9,09%C54,54%O36,36%, respectivamente.
Se 8 g de H2 reagem com 64 g de gás O2, produzindo 72 g de H2O, então a fórmula percentual é H11,11%O88,89%
A classificação periódica tem como base de organização o número atômico crescente dos elementos químicos, sendo possível, por meio dela, fazer previsões acerca das propriedades desses elementos.
Algumas propriedades periódicas, como o raio atômico e a energia de ionização, apresentam padrão de comportamento geral diferenciado se comparado ao padrão dos elementos de transição, principalmente os lantanídeos e os actinídeos.
A configuração eletrônica tem origem nos conhecimentos da mecânica quântica e permite explicar a ocorrência periódica das propriedades dos elementos.
As reações químicas ocorrem no núcleo. Dessa forma, os elementos químicos permanecem inalterados após reação com os demais elementos.
O experimento realizado por Rutherford, em que ele utilizou uma fonte de partículas alfa, contribuiu para a proposição de um modelo de estrutura atômica com um núcleo que contém partículas positivas e neutras e que concentra praticamente toda a massa do átomo. Ainda conforme esse modelo, ao redor do núcleo tem-se a eletrosfera, que contém partículas negativas de massa desprezível.
A configuração eletrônica dos elementos obedece a alguns princípios e regras, tais como o princípio da energia mínima, o princípio de exclusão de Pauli e a regra de Hund.
Átomos isótopos caracterizam-se por apresentarem o mesmo número de massa atômica.
2H2 + O2 → 2H2O.
Se foram utilizados 0,4 g de hidrogênio e 3,2 g de oxigênio, obtendo 3,6 g de água, quais as relações de massas entre hidrogênio e oxigênio e entre hidrogênio e água, respectivamente?
Dadas as massas molares: [Al2(SO4)3] = 342 g/mol; [Ca(OH)2] = 74 g/mol; [Al(OH)3] = 78 g/mol; [CaSO4] = 136 g/mol.
