Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.010 questões
Acerca das propriedades dos gases, julgue o item subsequente.
O gás é definido como a forma fluida da matéria que se expande espontaneamente, enche o recipiente que ocupa de maneira uniforme e pode ser facilmente comprimida a um volume muito menor. O volume, a pressão e a temperatura são variáveis usadas para descrever o comportamento dos gases.
5 g de gás hidrogênio (H2) foram misturados com 32 g de gás oxigênio (O2), em um recipiente de 10 L a 27 °C. Considerando o comportamento da mistura como o modelo de gás ideal, podemos informar que a pressão total do sistema em atmosfera vale:
Adotar nessa questão: R = 0,082 atm.L. mol-1 . K-1; T(K) = 273 + T(°C); Massas atômicas: H = 1 e O = 16.
Adotar nessa questão: R = 0,082 atm.L. mol-1 . K-1; T(K) = 273 + T(°C)
Das raízes da mandioca brava é obtido o caldo amarelado conhecido como tucupi. Em uma análise
química do tucupi, além de carbono, hidrogênio, nitrogênio e oxigênio (elementos presentes em
compostos orgânicos), foram encontrados também Ca, Cu, Fe, K, Mg, Mn, Na e Zn. Com base nesse
conjunto de informações, responda a questão.
I. A primeira energia de ionização, I1, é a quantidade de energia necessária para remover o elétron mais fracamente ligado de um átomo gasoso. II. A afinidade eletrônica é a alteração de energia quando um átomo gasoso ganha um elétron para formar um íon gasoso. III. É modo geral, ao longo de um período, a carga nuclear efetiva Zef aumenta e, consequentemente, fica mais difícil remover um elétron.
Está(Estão) correta(s) a(s) afirmativa(s)
A configuração eletrônica do átomo de ferro Fe e seu íon Fe (III) são, respectivamente,
Dado: número atômico do Fe= 26
Um estudante misturou 50 mL de solução aquosa de ácido sulfúrico 0,10 mol/L com 50 mL de solução aquosa de hidróxido de sódio 0,40 mol/L e introduziu algumas gotas de fenolftaleina. O processo pode ser representado pela equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(aq) + H2O(l)
Ao término da reação, pode-se concluir acertadamente queUm estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq) .Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
Dois recipientes contendo, respectivamente, gás oxigênio e gás nitrogênio a uma temperatura de 25 °C estão interligados conforme a figura abaixo:
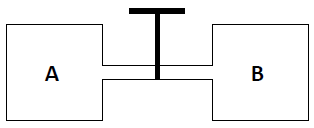
Sabe-se que o volume de oxigênio contido no
recipiente A é de 1,5 L e sua pressão é 0,5 atm e o
volume ocupado pelo nitrogênio no recipiente B é 0,5
L e sua pressão é 1,0 atm. Quando a válvula é
aberta, a pressão total da mistura e a fração molar
do gás oxigênio são em valores aproximados,
respectivamente
Mesmo que um modelo atômico consiga explicar muitos fenômenos ele não explica tudo o que acontece, e pode ser substituído. Em se tratando de modelos atômicos analise as proposições abaixo:
I. O modelo de Dalton foi um resgate da primitiva teoria atômica de Epicuro que viveu entre 341 a.C. e 270 a.C.
II. Rutherford postulou que o átomo era uma esfera maciça de carga positiva com cargas negativas incrustadas na superfície.
III. O modelo de Bohr repousava na mecânica clássica e explicava perfeitamente a existência de órbitas estacionárias.
IV. O modelo atual foi concebido com as contribuições de De Broglie, Heisenberg e Schrödinger.
V. O número quântico spin foi introduzido por Wolfgang Pauli para explicar a descoberta da duplicação das raias espectrais.
Está correto o que se afirma somente em
Atente para o que se afirma a seguir sobre as propriedades periódicas dos elementos químicos:
I. Considerando o segundo período da tabela periódica, é correto afirmar que quanto maior a atração entre núcleo e eletrosfera, menor é o raio atômico.
II. Energia de ionização é igual à energia mínima necessária para “arrancar” um elétron de um átomo isolado em estado gasoso.
III. Em um mesmo período da tabela periódica, como os raios diminuem à medida que se aproximam dos gases nobres, a energia de ionização tende a diminuir nesse mesmo sentido.
IV. Conforme nos deslocamos para baixo da tabela periódica, o raio atômico cresce num mesmo grupo. Os elétrons de valência ficam menos atraídos e a energia de ionização cai.
É correto o que se afirma em