Questões de Concurso
Comentadas sobre velocidade de reação, energia de ativação, concentração, pressão, temperatura e catalisador em química
Foram encontradas 294 questões
Figura: Dados cinéticos para uma reação de primeira ordem. Concentração versus tempo e velocidade versus tempo.
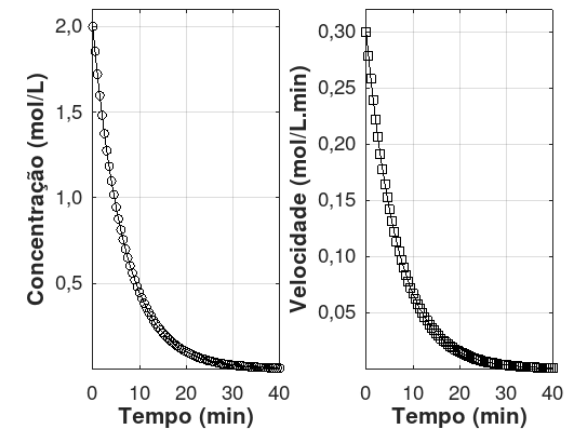
A partir da interpretação dos gráficos mostrados acima, assinale a opção que mostra corretamente O VALOR DO TEMPO DE MEIA-VIDA do processo, em minutos, com precisão de duas casas decimais: Dado: considere ln(2) = 0,693.
O NO produzido na estratosfera pela reação do N2O com o átomo de oxigênio participa da destruição do ozônio na atmosfera.
O NO produzido reage com o ozônio abstraindo um átomo de oxigênio, produzindo o NO2.
Para determinar a expressão da velocidade da reação do NO com o ozônio foram realizados em laboratório, experimentos cujos dados estão na tabela a seguir.
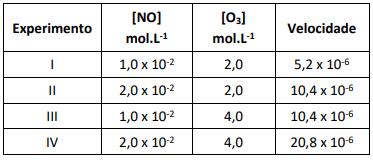
De acordo com os dados, assinale a expressão que descreve a lei da velocidade da reação.
Os catalisadores promovem reações
( ) A lei de velocidade é a equação matemática que exprime como as concentrações interferem na velocidade de uma reação a uma determinada temperatura.
( ) Só é possível determinarmos a ordem de uma reação somando os expoentes a que se devem elevar as concentrações dos reagentes exclusivamente para se obter a lei de velocidade de reação.
( ) Molecularidade é o número de moléculas que se chocam em cada etapa da reação.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
(Dados: C=12; H=1; O=16)
Assinale a alternativa que corresponde a reação de combustão do propano e a velocidade desta reação.
S2O8 –2 + 3 I– → 2 SO4 –2 + I3 –
A velocidade dessa reação, determinada experimentalmente, é expressa por:
v = k.[S2O8 –2].[I–]
Em relação ao exposto, assinale a alternativa que apresenta corretamente a ordem global da reação direta.
H2O2(aq) → H2O (l) + 0,5 O2 (g)
A Tabela abaixo foi construída a partir de dados experimentais e mostra a variação da concentração do peróxido de hidrogênio que vai se decompondo em função do tempo.
[H2O2] mol/L Tempo (min) 1,2 0 1 15 0,6 25 0,4 30 0,2 45 0,1 60
Tabela2. Dados experimentais da decomposição do peróxido de hidrogênio, à 1atm.
Diante do exposto, assinale a alternativa correta utilizando os dados acima.
NO(g) + O3(g) → NO2(g) + O2(g)
Dados cinéticos dessa reação obtidos a T = 298 K foram medidos por técnica de fluxo rápido; alguns desses dados constam no quadro a seguir.

A lei da velocidade para a reação mencionada é:
No que se refere às escalas de temperatura, julgue o item subsequente.
A temperatura pode ser determinada por uma escala
padronizada, equivalente ao conceito de energia do
movimento molecular. O zero absoluto é uma temperatura
em que o movimento das moléculas cessa, sendo esse valor,
na escala absoluta, ou escala Kelvin, igual a −273 K. Na
escala Kelvin, a temperatura absoluta é inversamente
proporcional à energia cinética média de translação das
moléculas de um gás.
X KO2(s) + Y CO2(g) ⇔ W K2CO3(s) + Z O2(g).
Calcule a massa de KO2 necessária para reagir com 50 l de CO2 a 25°C e 1,0 atm. A massa molar do KO2 é 71,1 g/mol. Considere o volume molar 24,5l/mol.
Assinale a alternativa que contém os valores de X, Y, W e Z e a massa de KO2 consumida na reação.
Reação: 6CO2(g) + 6H2O(l) ⇔ C6H12O6(g) + 6O2(g).
Considere massa molecular da glicose = 180 g/mol e volume molar = 24,5 l/mol.
Assinale a alternativa que contém a resposta correta.
I. Com o aumento da pressão, a reação deslocou-se na formação dos reagentes. II. Com o volume do recipiente sendo diminuído, a reação deslocou-se no sentido do produto. III. Quando adicionado calor, a reação favoreceu mais a formação do produto. IV. Com a adição de H2, a reação tende a formar mais produto. V. Com a adição de CO, a reação é deslocada para formar mais reagentes.
Estão corretas as afirmativas:
( ) A pressão total do sistema é maior que a soma das pressões parciais dos gases do experimento. ( ) A quantidade de matéria total no recipiente é a soma do número de mols de cada gás do recipiente. ( ) A pressão parcial de cada gás (Pi) é dado pela fração (ni/ntotal) da pressão final, representada pela equação Pi = Xi.P, onde Xi = ni/ntotal.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
I. As partículas se comportam tanto como onda e como partícula. II. As moléculas não influenciam umas às outras, nunca. III. As moléculas de um gás são pontos infinitesimalmente pequenos. IV. Um gás consiste em uma coleção de moléculas em movimento aleatório contínuo.
Estão corretas as afirmativas:
I. A pressão final será menor que a inicial pois houve a diminuição da temperatura do experimento. II. A pressão final será maior apesar de haver a diminuição da temperatura do experimento. III. A pressão final será menor que a inicial, pois na reação que ocorre no experimento, o número de mols do gás diminui, conforme Lei de Avogadro. IV. Não há alteração na pressão final, pois com a reação que ocorre no experimento, o número de mols do gás diminui enquanto a pressão aumenta, um compensando o outro.
Estão corretas as afirmativas:
Assinale a alternativa que preencha correta e respectivamente as lacunas.
