Questões de Concurso Público FIOCRUZ 2010 para Tecnologista em Saúde - Flexografia
Foram encontradas 20 questões
I. instalações, utilidades, sistemas computadorizados, equipamentos e processos foram projetados em consonância com as exigências de BPF (qualificação de projeto ou QP).
II. instalações, utilidades, sistemas computadorizados e equipamentos foram construídos e instalados de acordo com as suas especificações de projeto (qualificação de instalação ou QI).
III. instalações, utilidades, sistemas computadorizados e equipamentos operam de acordo com suas especificações planejadas (qualificação de operação ou QO).
IV. uma metodologia analítica e um processo específico produzirá um produto que consistentemente atenda suas especificações e atributos de qualidade (validação de processo ou VP, também chamada em alguns casos de qualificação de desempenho ou QD).
Assinale:
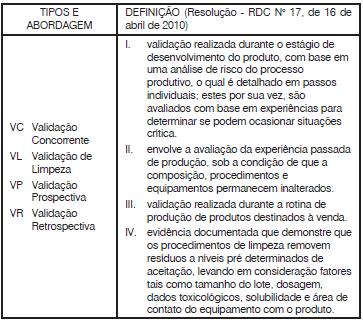
Estão corretas as associações
“dependendo da função e operação do equipamento, utilidade ou sistema, em determinadas situações, somente se fazem necessárias a __________ e a __________, assim como a operação correta do equipamento, utilidades ou sistemas pode ser considerada um indicador suficiente de seu __________."
De acordo com a legislação em referência, assinale a alternativa que melhor preenche os espaços da sentença.
I. O equipamento deve estar visualmente limpo.
II. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 10 ppm ou 10 mg/g do produto após a limpeza em relação ao produto subseqüente.
III. Qualquer agente ativo do produto após a limpeza deve estar presente em níveis máximos de 1/100 da dose mínima diária da substância ativa em relação à dose máxima diária do produto subseqüente, calculado de acordo com a equação seguinte (LeBlanc, 1999):
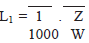
Onde:
L1 = Limite no produto subseqüente em mg/g
Z = Dose mínima diária do produto a ser limpo
Assinale: