Questões de Concurso Público SEED-PR 2023 para DOCÊNCIA DOS COMPONENTES CURRICULARES DA MATRIZ - QUÍMICA
Foram encontradas 30 questões
2HCl (aq) + CaCO3 (s) → CaCl2 (aq) + H2O (l) + CO2 (g)
Pensando nas condições normais de temperatura e pressão (CNTP), vamos calcular a massa de água, em gramas, e o volume de gás carbônico, que pode se formar a partir de 80g de carbonato de cálcio. Dados as massas atômicas de Ca= 40; C = 12; O=16. Assinale a alternativa que apresenta os valores encontrados.
I. 2 MnO2(s) + H2O(ℓ) + 2 e⁻ → Mn2O3(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H2O(ℓ) + 2 e⁻
As pilhas alcalinas começaram a ser produzidas no Brasil em 1978. A diferença básica entre essa pilha e a de Zn-C é que a primeira emprega célula eletroquímica com materiais ativos de maior grau de pureza. As pilhas alcalinas são mais resistentes a altas temperaturas, oferecem maior segurança contra vazamentos e duram de quatro a dez vezes mais que as Zn-C dependendo do uso. (https://www.scielo.br acesso em 16/04/2023)
Entre as vantagens dessa nova pilha está o fato de não ocorrer a formação de gases durante o processo redox, eliminando-se, portanto, os riscos de explosões. Sabendo-se que o potencial padrão de redução, E°, do zinco e do manganês, nos processos I e II, é -1,25 V e + 0,29 V, respectivamente, calcule a voltagem produzida pela pilha.
Considerando a formação do metano, a partir da reação:
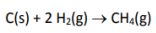
Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão:
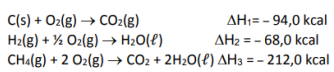
Assinale a alternativa correta.
I. Os químicos admitem que, ao se chocarem, as moléculas transformam parte de sua energia cinética em potencial, adquirindo, o conjunto resultante do choque, alta energia potencial. Este conjunto forma um composto intermediário, chamado complexo ativado.
II. O complexo ativado representa um estado instável que se chama estado de transição. Esse estado de transição comum à reação direta e à inversa.
III. Ao romper-se, o complexo pode tanto ocasionar a formação dos produtos como a recuperação dos reagentes. Em outras palavras, só conseguem formar o complexo ativado as moléculas com energia cinética mínima necessária que se choquem adequadamente.
Estão corretas as afirmativas:
I. 2 MnO₂(s) + H₂O(ℓ) + 2 e⁻ → Mn₂O₃(s) + 2 OH⁻(aq)
II. Zn(s) + 2 OH- (aq) → ZnO(s) + H₂O(ℓ) + 2 e⁻
(Dados: C=12; H=1; O=16)
Assinale a alternativa que corresponde a reação de combustão do propano e a velocidade desta reação.
( ) A lei de velocidade é a equação matemática que exprime como as concentrações interferem na velocidade de uma reação a uma determinada temperatura.
( ) Só é possível determinarmos a ordem de uma reação somando os expoentes a que se devem elevar as concentrações dos reagentes exclusivamente para se obter a lei de velocidade de reação.
( ) Molecularidade é o número de moléculas que se chocam em cada etapa da reação.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
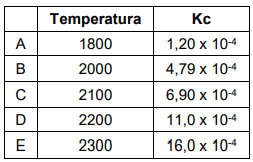
Diante dos valores acima, assinale a alternativa que apresenta maior concentração de monóxido de nitrogênio.