Questões de Concurso Público UFPR 2017 para Técnico de Laboratório - Química
Foram encontradas 20 questões
Foi requisitado a um técnico de laboratório que preparasse uma solução de hidróxido de amônio, a partir de uma solução comercial concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
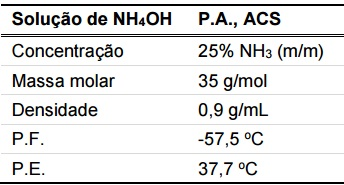
Assinale a alternativa que indica o volume aproximado da solução
comercial (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.
Antes da era do petróleo, compostos aromáticos eram obtidos pela destilação do alcatrão de hulha, o que possibilitou o grande desenvolvimento da indústria de corantes no século XIX. Nessa destilação, frações obtidas entre 160 e 270 ºC (óleos médios e pesados) contêm principalmente as substâncias ao lado:
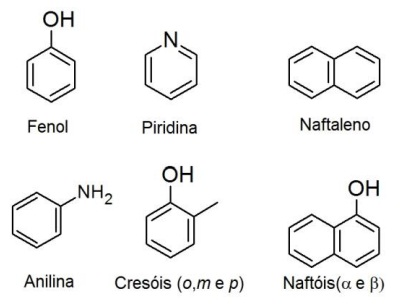
Uma separação posterior pode ser realizada levando-se em conta o comportamento de solubilidade dessas substâncias e também a sua reatividade diferenciada. Em um experimento, a mistura desses seis compostos foi solubilizada em hexano. A solução resultante foi transferida para um funil de separação e submetida às etapas operacionais detalhadas a seguir:
Etapa I) Solução hexânica foi extraída eficientemente com solução aquosa de HCl 10% e a solução ácida separada foi neutralizada com solução aquosa de NaOH 10%, que, após tratamento adequado, gerou a Fração A.
Etapa II) Solução hexânica resultante da Etapa I foi extraída eficientemente com solução aquosa de NaOH 10% e a solução alcalina separada foi neutralizada com solução aquosa de HCl 10%, que, após tratamento adequado, gerou a Fração B.
Após a realização das duas etapas subsequentes, a fração hexânica residual foi denominada Fração C.
Com base nessas informações, assinale em qual fração (A, B ou C) se encontra cada composto:
( ) Fenol.
( ) Piridina.
( ) Naftaleno.
( ) Anilina.
( ) Cresóis.
( ) Naftóis.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O ácido fluorídrico (HF(aq.)) é utilizado na gravação de vidro, pois esse composto reage com o SiO2 segundo as seguintes reações:
SiO2(s) + 4HF(aq.) → SiF4(g) + 2H2O(l) (Equação I)
SiO2(s) + 6HF(aq.) → H2[SiF6](aq.) + 2H2O(l) (Equação II)
Devido à toxidez do SiF4(g), qual das ações a seguir poderia evitar a formação desse composto no processo descrito?
O ácido fosfórico (H3PO4) de alta pureza é obtido por via seca ou térmica, pela combustão do fósforo elementar e posterior hidratação do P2O5, de acordo com as reações abaixo:
4P + 5O2 → 2P2O5 ΔH= -720 kcal
P2O5 + 3H2O → 2H3PO4 ΔH= -45 kcal
Nesse processo, de acordo com as equações acima, assinale a alternativa que apresenta a quantidade de calor liberado
na formação do H3PO4 (em kcal/mol).
A utilização de conversores catalíticos no escapamento de automóveis diminui a emissão de gases tóxicos que são também geradores de compostos ácidos, como indicado nas seguintes equações:
2CO + 2NO → 2CO2 + N2
2CO + O2 → 2CO2
2NO → N2 + O2
Em um teste de laboratório, foram colocadas em um reator inextensível quantidades estequiométricas de CO, NO, O2 e
catalisador. Considerando que o experimento foi realizado nas CNTP, que os reagentes e os produtos são gases ideais e
que a conversão foi de 100%, qual será a pressão final do sistema, em atm?