Questões de Concurso Público UFPR 2017 para Técnico de Laboratório - Química
Foram encontradas 5 questões
Artefatos de aço inoxidável são resistentes à corrosão devido a um fenômeno conhecido como passivação, que é a formação de uma fina camada de óxido de cromo na superfície, por ação do ar ou de oxidantes químicos. Sabendo-se que o ácido nítrico (HNO3) na concentração de 1,6 mol/L pode ser usado como agente passivante, qual volume de HNO3 concentrado (em litros) deve ser utilizado para a obtenção de 100 L de solução passivante?
(Dados: MM(HNO3) = 63,0 g/mol; HNO3 concentrado: d = 1,40 g/mL; teor máximo = 65%(m/m))
O índice de acidez (Ia) de óleos e gorduras é um dos parâmetros para a determinação de sua qualidade, visto que, quanto maior o grau de decomposição dos lipídeos, mais alta é sua acidez. Na determinação do Ia, uma quantidade conhecida de amostra (mA) é dissolvida num solvente apropriado (p.e. etanol) e titulada com uma solução padronizada de NaOH de concentração CB, utilizando-se fenolftaleína como indicador. Sabendo que o Ia é definido como a massa de KOH (em miligramas) necessária para neutralizar 1 grama de amostra, dado pela equação
Ia = mKOH(mg) / mA(g),
e que o volume de solução de NaOH utilizado na titulação é VB, assinale a alternativa que apresenta a expressão para o cálculo do Ia, de acordo com os dados obtidos experimentalmente.
Dados: massa molar do KOH = 56,1 g/mol
Na determinação de cálcio em águas naturais, a AOAC (Association of Official Analytical Chemists/USA) recomenda um método gravimétrico que consiste em adicionar excesso de ácido oxálico (C2H2O4) a um volume conhecido de amostra e, em seguida, adicionar a quantidade necessária de NH4OH. O precipitado obtido é filtrado, seco, calcinado e pesado, e a massa de CaO obtida é utilizada para calcular a quantidade de Ca na amostra que, segundo a norma da AOAC, deve ser expressa como teor de carbonato de cálcio. O método citado é ilustrado pelas equações a seguir. Na análise de uma amostra de 100,00 mL de água, a massa de CaO obtida foi de 0,2800 g.
Ca+2(aq.) + C2O4 -2 (aq.) → CaC2O4(s)
CaC2O4(s) → CaO(s) + CO + CO2
Dados: Massas molares aproximadas: MM(C2H2O4.2H2O) = 126 g/mol; MM(CaO) = 56 g/mol; MM(CO2) = 44 g/mol, MM(CaCO3) = 100 g/mol; densidade (H2O) = 1,0 kg/L.
De acordo com os dados apresentados, qual é a concentração de cálcio na amostra de água analisada, expressa em ppm
de CaCO3?
O ácido etilenodiamino tetra-acético (EDTA) é usado como “sequestrante” em detergentes, impedindo a precipitação do surfactante (princípio ativo) pelos íons Ca+2, Mg+2 e Fe+3 presentes na água. Em análise química, o EDTA é utilizado como titulante para a determinação de dureza (Ca+2 , Mg+2) de águas, cujo sal dissódico é obtido pela seguinte reação:
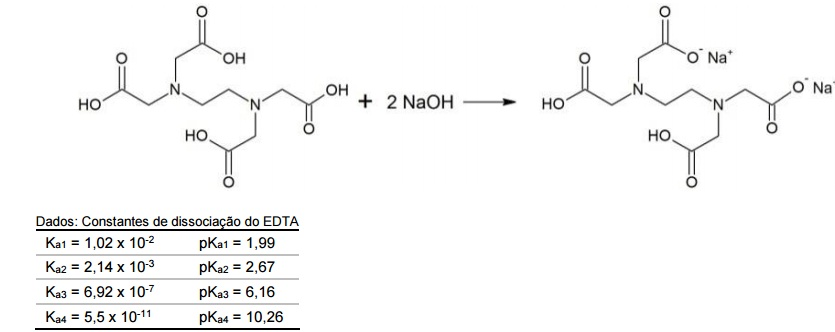
De acordo com a reação de neutralização parcial do EDTA acima apresentada, assinale a alternativa que apresenta o
intervalo de pH no qual é obtido apenas o sal dissódico.
Foi requisitado a um técnico de laboratório que preparasse uma solução de hidróxido de amônio, a partir de uma solução comercial concentrada, cujo rótulo contém as informações ao lado:
Dados: MM(NH3) = 17g/mol
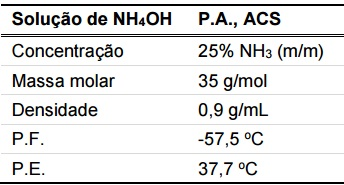
Assinale a alternativa que indica o volume aproximado da solução
comercial (em mL) que o técnico deve utilizar para obter 5 litros de
uma solução de NH4OH 1 mol/L.