As enzimas são moléculas de proteínas com grande massa molar...
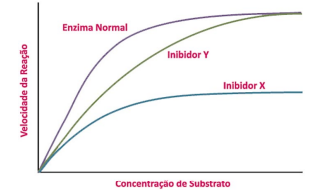
I. Na curva da reação cinética da enzima normal, os valores de V0 aumentam rapidamente com baixas concentrações de substrato e passam a se nivelar em um platô com altas concentrações desse mesmo substrato. Esse platô ocorre porque todas as moléculas da enzima disponíveis se encontram ligadas ao substrato e quaisquer moléculas adicionais do substrato terão que aguardar ser processadas até que outra molécula dessa enzima se torne disponível. Por isso, a velocidade da reação é limitada pela concentração da enzima e o seu valor máximo, ou Vmax, é o valor da velocidade inicial de reação no qual a enzima normal atinge o platô.
II. O inibidor X é um inibidor competitivo porque retarda o progresso da reação ao se ligar à enzima, que ocorre geralmente no sítio ativo, impedindo que o verdadeiro substrato se ligue. Portanto, o inibidor e o substrato competem pela enzima. A inibição competitiva age diminuindo o número de moléculas enzimáticas disponíveis para se ligar ao substrato.
III. O inibidor Y é um inibidor não competitivo, porque não impede que o substrato se ligue à enzima. O inibidor e o substrato não interferem na capacidade um do outro de se ligar à enzima. Contudo, quando o inibidor está ligado, a enzima não é capaz de catalisar a reação para gerar um produto. Portanto, a inibição não competitiva age reduzindo o número de moléculas funcionais da enzima que pode realizar a reação.
Assinale
Gabarito comentado
Confira o gabarito comentado por um dos nossos professores
Clique para visualizar este gabarito
Visualize o gabarito desta questão clicando no botão abaixo
Comentários
Veja os comentários dos nossos alunos
As definições dadas em II e III estão corretas. Porém, o tipo de inibidor indicado em X e Y está incorreto.
X= inibidor competitivo
Y= inibidor NÃO competitivo
Com um inibidor competitivo, a reação irá atingir sua Vmax normal, mas precisará de uma maior concentração de substrato. Em outras palavras, a Vmax permanece inalterada, mas a Km aparente é maior. Por que se deve adicionar mais substrato para que se chegue à Vmax? O substrato extra torna as moléculas de substrato suficientemente abundantes para "vencerem" as moléculas inibidoras da enzima.
Com um inibidor não competitivo, a reação nunca atinge sua Vmax normal, independentemente de quanto substrato adicionarmos. Uma parcela das moléculas enzimáticas sempre estarão "envenenadas" pelo inibidor, então a concentração efetiva de enzimas (que determina a Vmax) é reduzida. Contudo, a reação atinge a metade de sua nova Vmax na mesma concentração de substrato, portanto a Km permanece inalterada. A km inalterada mostra que o inibidor não afeta a capacidade da enzima de ligar-se ao substrato, apenas diminui a concentração de enzimas utilizáveis.
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo