Analise as afirmativas abaixo e assinale a alternativa
correta. Um dos primeiros relatos da literatura
que indicava a relevância da estereoquímica, mais
particularmente da configuração absoluta na atividade
biológica de fármacos, deve-se a Piutti em 1886, que
descreveu o isolamento e as diferentes propriedades
gustativas dos enantiômeros da asparagina. Essas
diferenças de propriedades organolépticas expressavam
modos diferenciados de reconhecimento molecular do
ligante pelo sítio receptor, neste caso, localizado nas
papilas gustativas, traduzindo sensações distintas.
Entretanto, a importância da configuração absoluta
na atividade biológica permaneceu obscura até a
década de 60, quando ocorreu a tragédia da talidomida,
decorrente do uso da sua forma racêmica, indicada
para a redução do desconforto matinal em gestantes,
resultando no nascimento de cerca de 12.000 crianças
com deformações congênitas. Posteriormente, o estudo
do metabolismo da talidomida permitiu evidenciar
que o enantiômero (S) era seletivamente oxidado,
levando à formação de espécies eletrofílicas reativas
do tipo areno-óxido, que reagem com nucleófilos bioorgânicos, induzindo teratogenicidade, enquanto
a antípoda (R) era responsável pelas propriedades
sedativas e analgégicas. Esse episódio foi o marco da
nova era do desenvolvimento de novos fármacos. Então,
a quiralidade passou a ter destaque, e a investigação
cuidadosa do comportamento de fármacos quirais ou
homoquirais frente a processos capazes de influenciar
tanto na farmacocinética como (i.e., absorção, interação
fármaco-receptor) passou a ser fundamental antes de
sua liberação para uso clínico. I. Apesar do modelo chave-fechadura ser útil
na compreensão dos eventos envolvidos no
reconhecimento molecular ligante-receptor, caracteriza-se como uma representação parcial da realidade, uma
vez que as interações entre as biomacromoléculas
e a micromolécula apresentam características
tridimensionais dinâmicas.
II. Dessa forma, o volume molecular do ligante, as
distâncias interatômicas e o arranjo espacial entre
os grupamentos farmacofóricos* compõem aspectos
fundamentais na compreensão das diferenças na
interação fármaco-receptor.
III. Sendo moléculas de estruturas definidas, absolutas,
fatores como pH e temperatura têm pouca influência
na ação e reatividade de fármacos quirais, uma vez
que tais condições não são capazes de levar a sua
isomerização.
IV. A presença da talidomida (S) numa mistura racêmica
pode ser comprovada por espectroscopia de absorção
no infravermelho, desde que antes seja separada de
seu isômero por cromatografia líquida de alta resolução
em coluna aquiral.
*Grupo farmacofórico é o conjunto de características
eletrônicas e estéricas que caracterizam um ou
mais grupos funcionais ou subunidades estruturais,
necessários ao melhor reconhecimento molecular
pelo receptor e, portanto, para o efeito farmacológico
desejado
Assinale a alternativa correta:
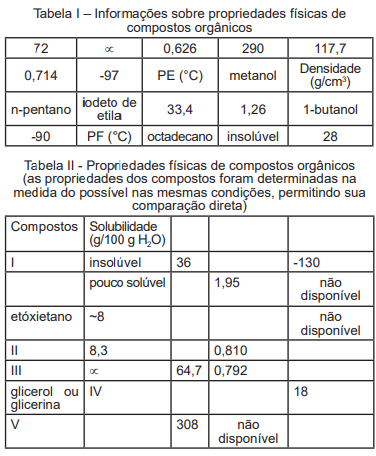 I. Sabendo-se que o composto I tem densidade de
0,626 g/cm3
, a menor densidade da lista de compostos
apresentados, ele certamente representa o n-pentano,
pois tal composto possui também baixo ponto de
ebulição e é insolúvel em água.
II. O composto II representa o n-butanol e seu ponto de
fusão é -97°C.
III. O composto III representa o metanol e sua mais alta
solubilidade em relação ao n-butanol está relacionada a
sua maior interação por ligação de hidrogênio, já que a
molécula é menor.
IV. A glicerina ou glicerol (também conhecida como 1, 2, 3-
propanotriol) tem ponto de ebulição muito alto, 290°C,
devido aos grupos hidroxila, mesmo motivo que deixa
este composto extremamente solúvel em água. Assim
sendo, IV representa o símbolo do infinito.
V. O composto V é sólido à temperatura ambiente de 25°C. Assinale a alternativa correta:
I. Sabendo-se que o composto I tem densidade de
0,626 g/cm3
, a menor densidade da lista de compostos
apresentados, ele certamente representa o n-pentano,
pois tal composto possui também baixo ponto de
ebulição e é insolúvel em água.
II. O composto II representa o n-butanol e seu ponto de
fusão é -97°C.
III. O composto III representa o metanol e sua mais alta
solubilidade em relação ao n-butanol está relacionada a
sua maior interação por ligação de hidrogênio, já que a
molécula é menor.
IV. A glicerina ou glicerol (também conhecida como 1, 2, 3-
propanotriol) tem ponto de ebulição muito alto, 290°C,
devido aos grupos hidroxila, mesmo motivo que deixa
este composto extremamente solúvel em água. Assim
sendo, IV representa o símbolo do infinito.
V. O composto V é sólido à temperatura ambiente de 25°C. Assinale a alternativa correta: