Questões de Concurso Comentadas por alunos sobre transformações químicas em química
Foram encontradas 1.358 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
“O chumbo é o segundo metal pesado mais perigoso, ao lado do mercúrio, do arsênio e do cádmio. Ele causa asma, problemas gástricos, retardamento mental, entre outros”.
O chumbo (Z=82), elemento de grande utilidade, está localizado na tabela periódica
Nos fogos de artifício, no momento em que a pólvora explode, a energia excita os elétrons dos átomos que mudam de níveis de energia. Essa movimentação eletrônica é marcada pela emissão de luz colorida. Esse fenômeno é explicado pelo modelo atômico de Bohr.
Com base nos postulados do modelo atômico descrito no enunciado, pode-se aferir que
Uma das matérias primas utilizadas na fabricação do cimento é o óxido de cálcio, também conhecido como cal virgem. Esse óxido pode ser obtido a partir da reação de decomposição do carbonato de cálcio, conforme mostra a equação abaixo:
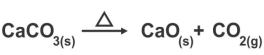
Quantos gramas de óxido de cálcio podem ser obtidos a partir da decomposição de 300 g de
carbonato de cálcio?
O teste de chamas, utilizado para a detecção qualitativa de alguns cátions metálicos, é possível porque o comprimento de onda da luz visível emitida por cada átomo/íon é percebido como cor. Observe a tabela com os comprimentos de onda no vácuo referentes ao espectro da luz visível.
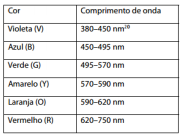
Em um ensaio de chama, para evitar confusões visuais das cores, a detecção foi realizada com auxílio de um
Colorímetro, que apresentou, para as amostras aquosas A, B e C, os comprimentos de onda 425 nm, 540 nm e 580 nm,
respectivamente. É correto afirmar que as amostras, nesta ordem, contêm cátions dos metais:
Quando se estudam as diferentes classes de compostos inorgânicos mais comuns, percebe‐se que podem ser obtidas em um laboratório de química sem necessidade de aparatos complexos. Como exemplos, abaixo seguem propostas de algumas reações de obtenção de óxidos, ácidos, bases e sais:
I. Pb(NO3)2(s) 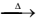 PbO(s) + 2 NO(g) + 1,5 O2(g)
PbO(s) + 2 NO(g) + 1,5 O2(g)
II. CaO(s) + SiO2(S) 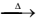 CaSiO3(L)
CaSiO3(L)
III. Cu(s) + H2SO4(conc) → CuSO4(aq) + H2(g)
IV. (NH4)2Cr2O7(s) 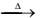 N2(g) + Cr2O3(s) + 4 H2O(L)
N2(g) + Cr2O3(s) + 4 H2O(L)
V. 2 NO2(g) + H2O(L) → HNO3(aq) + HNO2(aq)
VI. Pb(NO3)2(aq) + Fe(s) → não reativa
Das possibilidades de reações químicas apresentadas anteriormente, estão quimicamente corretas, de acordo com os
processos de síntese e reatividade dos compostos inorgânicos, apenas