Questões de Concurso
Foram encontradas 1.388 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Ca5(PO4)3 F + H3PO4 + H2O HF + Ca(H2PO4)2 . H2O (I)
Em um processo industrial, partiu-se de 1 tonelada de fluorapatita fazendo-a reagir com uma quantidade suficiente de ácido fosfórico obtendo-se, ao final, 2 toneladas do produto di-hidrogenofosfato de cálcio monohidratado. Pode-se, por esses dados, prever que a pureza do mineral utilizado, em percentual, era aproximadamente igual a:
(Dados, em g/mol: Ca= 40, P=31, O=16, H=1, F=19)
(Dados em g/mol: Na= 23, O = 16, H = 1)
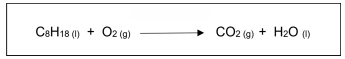
Para queimar completamente 2,00 mols de octano, serão necessários: