Questões de Concurso
Foram encontradas 1.092 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
KClO3(s) → KCl(s) + 3/2O2(g)
Essa sua propriedade é frequentemente usada em laboratórios de ensino secundário e superior para produzir gás oxigênio. Nas CNTP, uma amostra de 136 g desse sal com pureza de 90%, em uma decomposição com rendimento de 80%, libera aproximadamente qual volume de gás?
Dados: KClO3 = 122,5u
Volume molar CNTP = 22,7 L
Adaptado.Produção de Alumínio: Extração da Bauxita, Obtenção na Eletrólise (culturalivre.com). (Acesso em 24 de Julho de 2021).
Podemos resumir a reação de obtenção do alumínio a partir do óxido de alumínio por meio da seguinte equação química balanceada. 2 Al2O3 (l) + 3 C(s) → 4 Al (l) + 3 CO2 (g) Dados: Massas atômicas (g/mol) Al=27; C=12; O=16. Assinale a alternativa que apresenta a massa, em gramas, de alumínio produzida se tivermos o triplo da quantidade, em mol, de óxido de alumínio e carvão.
Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
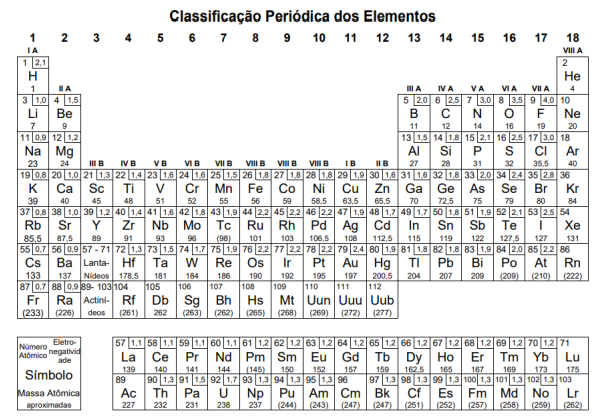
10KNO3(s) + 8C(s)+ 3S(s) ➝ 5N2(g) + 6CO2(g) + 2K2CO3(s) + 3K2SO4(s)
Durante um teste envolvendo a queima de pólvora negra ao ar, foram recolhidos 75L de gás nitrogênio. Sabendo que o rendimento do processo foi de 100%, é correto afirmar que a massa de pólvora negra, em grama, usada no teste foi de
(Dado: volume molar = 25 L.mol-1 )
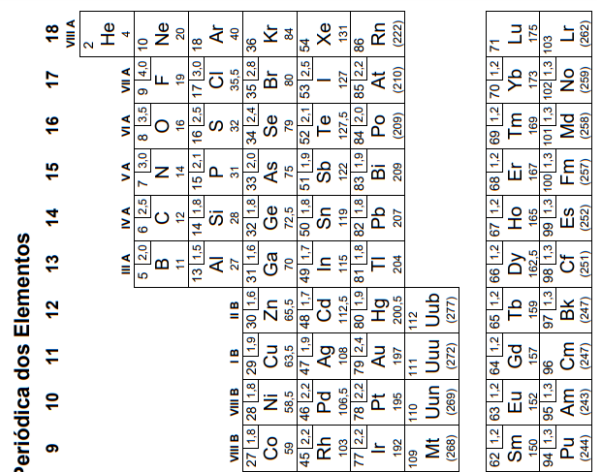
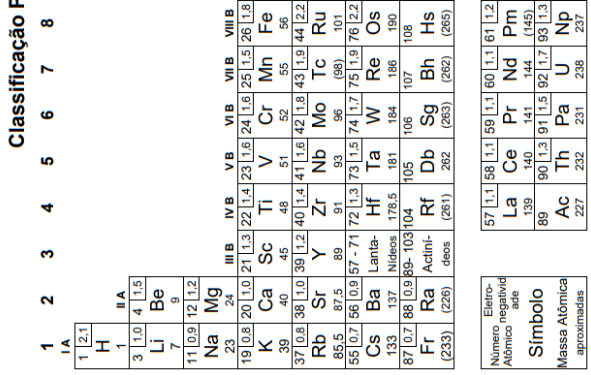
O elemento X é o