Questões de Concurso
Foram encontradas 1.388 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
CaCO3 (S) → CaO (S) + CO2 (g) ΔH° = 180 kJ/mol
O calor consumido na decomposição de 500 g de CaCO3 é igual a:
Dado: massa molar do CaCO3 = 100 g/mol
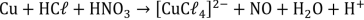
A soma dos menores coeficientes inteiros que balanceiam a equação é:
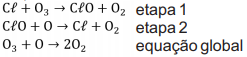
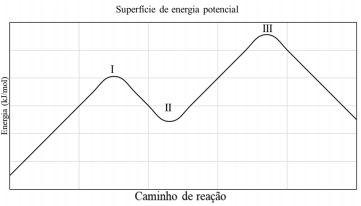
Ao comparar o mecanismo com a SEP, pode-se concluir que a espécie II indicada no diagrama é o: