Questões de Concurso
Foram encontradas 2.902 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
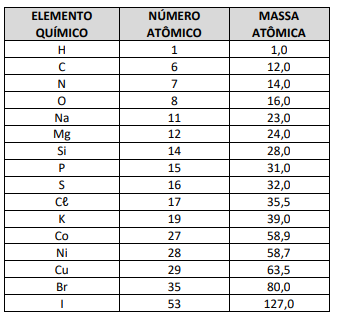
1ª. Etapa: S + O2 → SO2 2ª. Etapa: SO2 + O2 → SO3 3ª. Etapa: SO3 + H2O → H2SO4
Ao fazermos o balanceamento para as 2ª e 3ª etapas, utilizando somente os menores coeficientes inteiros, assinale a alternativa correta.
Uma das formas da obtenção do gás nitrogênio é através da reação química do sódio com o nitrato de potássio. Sua equação química, não ajustada, é:
Na(s) + KNO3(s) → K2O(s) + Na2O(s) + N2(g).
Assinale a opção que corresponde aos coeficientes do par
das substâncias, reagente e produto.
A variação de energia livre relacionada à reação de combustão do etanol, apresentada pela equação a seguir, é mais próxima do comportamento descrito pela seguinte letra (correspondente no gráfico):
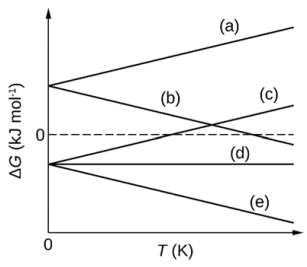
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g)
Ventura, D. O lendário azul da Prússia, cor que pode salvar ou tirar vidas. Disponível em www.bbc.com. Adaptado.
A distribuição eletrônica na valência do par associado à conversão eletroquímica de oxidação mencionada no texto é descrita por: