Questões de Concurso Comentadas por alunos sobre equilíbrio químico em química
Foram encontradas 854 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
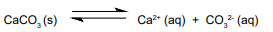
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
A seguir, uma curva típica de pH em função do volume adicionado para uma titulação.
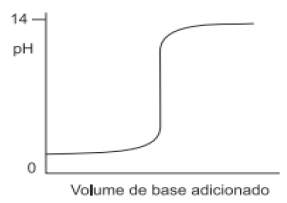
Observando essa curva, assinale a alternativa que apresenta, respectivamente:
I. O pH de viragem para uma titulação ácido forte-base forte completa (o ponto de equivalência); II. O titulante utilizado (ácido/básico).
