Questões de Concurso Comentadas por alunos sobre transformações químicas e energia em química
Foram encontradas 985 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
1 C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 H2O(g)
Calcule o calor liberado na reação acima, a 298 K, a partir das entalpias-padrão de formação, ΔHfº , a 298 K.

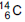 (emissor de partículas
(emissor de partículas 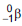 com tempo
de meia-vida de 5.730 anos), de acordo com a
equação da reação:
com tempo
de meia-vida de 5.730 anos), de acordo com a
equação da reação: 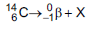
Qual é a substância X formada após a desintegração do isótopo
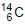 ?
?4 Au(s) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 NaAu(CN)2(aq) + 4 NaOH(aq)
Com relação à reação acima, podemos afirmar que:
1. O NOX do Au varia de zero para +1; assim, o ouro sofre oxidação e, portanto, é o agente redutor.
2. É uma reação redox, mas não há variação no número de oxidação do sódio.
3. Cada mol de O2 recebe 4 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):
CO(g) + CH3OH(l) → CH3COOH(l).
Utilizando os valores das entalpias de formação padrão da tabela a seguir, calcule a entalpia padrão da reação, ∆H°, e determine se a mesma é endotérmica ou exotérmica.
Composto Entalpia de formação ∆Hf°, kJ.mol−1
CO(g) −110,53
CH3OH(l) −238,86
CH3COOH(l) −484,50
Al3+(aq) + 3 e− → Al(s) E°= -1,66 V Pb2+(aq) + 2 e− → Pb(s) E°= -0,13 V
Calcule o potencial-padrão, ∆E°, da célula galvânica (pilha) e assinale a alternativa correta.