Questões de Concurso Comentadas por alunos sobre equilíbrio químico em química
Foram encontradas 849 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de
equilíbrio da reação de decomposição do H2O2 é superior ao
verificado em temperaturas mais baixas.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização
ácida do H2O2 é superior a 2,0%.


Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
Considere que a reação entre antimônio e sulfeto produza
o sal Sb2S3, pouco solúvel e de cor ocre que, em meio
aquoso, dissocia-se parcialmente, de acordo com o
equilíbrio Sb2S3(s)2Sb3+(aq) + 3S2-
(aq). Nesse caso,
a concentração de sulfeto necessária para iniciar a formação
do sólido Sb2S3 em uma solução aquosa de Sb3+
de concentração x mol/L deverá ser maior que
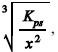 em que Kps é a constante de equilíbrio da reação precedente.
em que Kps é a constante de equilíbrio da reação precedente.