Questões de Concurso Comentadas por alunos sobre transformações químicas e energia em química
Foram encontradas 985 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!


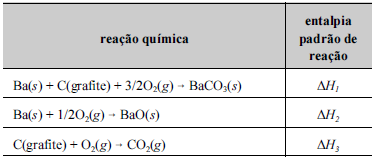
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
Se, na queima de um artefato pirotécnico ocorrera decomposição do carbonato de bário, de acordo coma reação química BaCO3(s) → BaO(s) + CO2(g), entãoa entalpia padrão dessa reação de decomposição (ΔHx),calculada a partir dos dados listados na tabela seguinte,será ΔHx = ΔH1 - ΔH2 + ΔH3.
( ) Se ΔG = 0, a reação não ocorre. ( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto). ( ) Se ΔG < 0, a reação é espontânea no sentido direto (reagentes→ produtos). ( ) Se ΔG > 0, a reação é espontânea no sentido indireto (produtos→reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
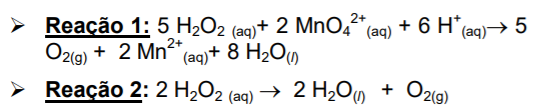
Com relação às informações dadas, podemos afirmar que:
I. A determinação de peróxido é um método complexiométrico. II. A expressão da concentração, em volumes decorre da auto protólise do peróxido. III. Na reação de permanganometria, o peróxido de hidrogênio é o agente redutor. IV. Para este procedimento deve ser empregado um indicador metalocrômico. V. A expressão “volumes de água oxigenada” se deve à geração de oxigênio na sua decomposição.
Estão CORRETAS apenas as afirmativas: