Questões de Concurso Comentadas por alunos sobre cinética e cálculo de reatores em engenharia química e química industrial
Foram encontradas 138 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
 , obtido como subproduto da eletrólise do
, obtido como subproduto da eletrólise do  , é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno
, é largamente empregado na indústria em reações de hidrogenação, como a que ocorre com o eteno  , representada pela seguinte
, representada pela seguinteequação:

A tabela seguinte contém as energias livres de Gibbs padrão de formação
 a 25 ºC de cada composto envolvido.
a 25 ºC de cada composto envolvido.
O gráfico a seguir mostra o ln da constante de velocidade da referida reação (k) em função do inverso da temperatura (1/T) para a reação catalisada por dois diferentes metais.

A constante de equilíbrio para a reação de hidrogenação do
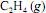 a 100 ºC é maior que a 25 ºC.
a 100 ºC é maior que a 25 ºC. 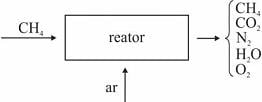
Em um reator ideal, de processo contínuo, que opera em estado estacionário, a combustão de
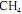 ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com
ocorre com uma conversão de 90% do reagente limitante. Esse reator é alimentado com 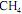 e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado.
e ar a taxas de 16 kg/h e 300 kg/h, respectivamente, conforme ilustrado no esquema apresentado. Considerando que, nessa situação, a combustão do
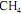 seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de
seja completa e que a composição do ar que alimenta o reator seja de 24%, em massa, de 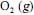 e, o restante, de
e, o restante, de 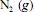 , julgue o item subsequente.
, julgue o item subsequente.A porcentagem, em massa, de
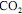 na corrente de saída do reator é superior a 10%.
na corrente de saída do reator é superior a 10%. 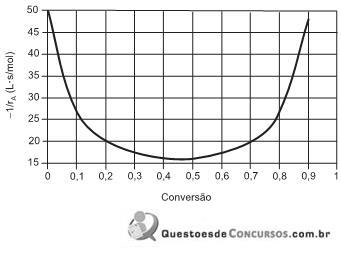
Considere uma reação que se processa em fase líquida em dada temperatura. Acima está representado o inverso da taxa de reação do reagente A em função de sua conversão. Se 30 mol/s do reagente A são alimentados a uma concentração de 3 mol/L, em um CSTR, desejando-se atingir uma concentração de 0,9 mol/L de reagente na saída, o volume do reator, em litros, será aproximadamente de
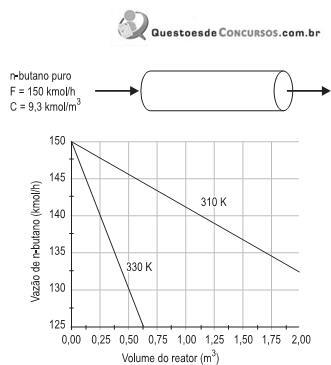
n-butano → i-butano r = k . C n-but
e onde r é a taxa de reação, C n-but é a concentração de n-butano, e k é constante da reação. A constante de reação segue a lei de Arrhenius, na forma
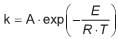
onde A é o fator pré-exponencial, E é a energia de ativação, R é a constante universal dos gases, e T é a temperatura. O valor de de E/R , em K, é dado por
 onde β é tal que
onde β é tal que
CO(g) + H2 O(g) ↔ CO2(g) + H2(g) (1)
Nessa temperatura, a constante de equilíbrio da reação assume o valor de K1 = 54,6. Além disso, a corrente de alimentação do reator contém água e monóxido de carbono na razão molar de 2:1, respectivamente.
Sabendo-se que a razão molar entre água e dióxido de carbono na saída do reator é de 1,035, a razão molar entre hidrogênio e monóxido de carbono na saída do reator é de