Questões de Concurso
Foram encontradas 9.182 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O alumínio já foi o metal mais caro do mundo. Por isso, Napoleão disponibilizava talheres e pratos de alumínio para convidados especiais nos banquetes, enquanto os menos favorecidos usavam de ouro. Em 1855, o norte-americano Charles Martin Hall e o francês Paul Louis Toussaint Héroult descobriram e patentearam quase simultaneamente um processo de obtenção de alumínio a partir do minério bauxita, rico em óxido de alumínio.
KEAN, Sam. A colher que desaparece: Editora Zahar, 2011 (adaptado).O processo ficou conhecido como Hall-Heróult e permitiu o estabelecimento da indústria global do alumínio, cuja obtenção ocorre por meio de:
“A maior ameaça à camada de ozônio no século XXI é o gás hilariante (N2O - óxido nitroso). Segundo o Pnuma (Programa das Nações Unidas para o Meio Ambiente), análises de cientistas de 35 organizações revelaram que o N2O, agora, é o gás mais importante a exaurir o ozônio e o terceiro mais poderoso gás do aquecimento global emitido na atmosfera. Os níveis de N2O aumentaram nas últimas décadas, puxados sobretudo pelos processos de nitrificação e de desnitrificação dos fertilizantes nitrogenados no solo.”
Disponível em: <https://www.terra.com.br/noticias/ciencia/clima/onu-faz-soaroxido-nitroso-a-camada-de-VgnCLD2000000dc6eb0aRCRD.html>. Acesso em: 24 nov. 2020.
O mecanismo de destruição pode ser resumido pelas seguintes equações:
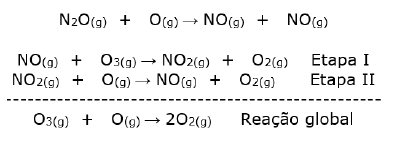
A classificação química do óxido nitroso e a função do NO no mecanismo de destruição do ozônio são, respectivamente:
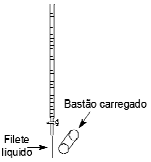
Filetes de líquidos polares são desviados por objetos eletrizados e filetes de líquidos apolares não sofrem desvios. MARTINO, A. Química, a ciência global Goiânia: Editora W, 2016 (adaptado)
Considerando o exposto, qual dos líquidos sofrerá atração pelo bastão?
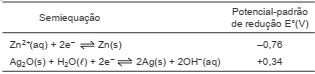
A pilha de zinco e óxido de prata é usada em aparelhos auditivos e relógios de pulso e são menos poluentes do que a de zinco e óxido de mercúrio.
Tendo em vista essas informações e os dados da tabela de
potencial-padrão de redução para as semiequações que
ocorrem nessa pilha, é correto afirmar:
Cr2O2-7 (aq) + Cℓ− (aq) + H+ (aq) → Cr3+(aq) + H2O(ℓ) + Cℓ2(g)
No balanceamento de equações de oxirredução, algumas espécies transferem elétrons para outras, de forma que, no final da reação química, o número de elétrons transferidos é igual ao de elétrons recebidos.
Com base nessas informações e após o balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
I. 2H+(aq) + 1/2O2(aq) + 2e- → H2O(ℓ) Eºred = + 1,23v
II. Fe3+(aq) + e- → Fe2+(aq) Eºred = +0,77
As soluções aquosas ácidas de sais de íons Fe2+(aq) são esverdeadas quando recém-preparadas e, quando em contato prolongado com o ar, tornam-se amareladas.
A partir dessas considerações e das semiequações I e II
com os respectivos potenciais-padrão de redução, é correto
afirmar:
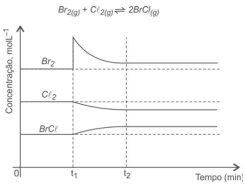
O gráfico representa a variação das concentrações de reagentes e de produto, em função do tempo, da reação química realizada no interior de um sistema fechado inicialmente em equilíbrio químico, a temperatura e volumes constantes, representado pela equação química.
A análise desse gráfico permite corretamente concluir:
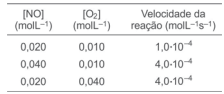
Utilizando-se de experimentos bastante elaborados, os químicos têm investigado o percurso das reações químicas, com o objetivo de determinar a expressão da lei da velocidade e verificar se essas reações são elementares ou não elementares. A tabela apresenta as concentrações colhidas durante três experimentos envolvendo a reação do monóxido de nitrogênio, NO(g), com o oxigênio, O2(g), na obtenção de dióxido de nitrogênio, NO2(g), à determinada temperatura.
A partir da análise dos dados da tabela e das informações
do texto, é correto afirmar que a
Na produção de picles, uma espécie de conserva, legumes, a exemplo de cebola, cenoura e pepino, são colocados durante alguns dias em uma salmoura, NaCl(aq). Após o período, são notadas alterações no sabor e na textura dos alimentos.
Com base nos efeitos dos solutos sobre as propriedades dos líquidos, é correto afirmar:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo = − 890kJ
A energia elétrica proveniente de biomassa é uma alternativa amplamente utilizada por grandes empresas do agronegócio nas regiões sul e sudoeste. A energia produzida não somente atende às necessidades dos empreendimentos, como também é vendida a concessionárias na região. A fermentação de restos de vegetais e de dejetos de animais coletados nas fazendas de pecuária e de suinocultura é processada em biodigestores e produz biogás, uma mistura gasosa de metano, CH4(g), sulfeto de hidrogênio, H2S(g) e dióxido de carbono, CO2(g), dentre outros gases, e resíduos ricos em bionutrientes usados como fertilizantes na propriedade rural. A combustão do metano, mostrada pela equação química, libera calor utilizado na geração de energia elétrica.
De acordo com essas informações sobre o processo de
geração de energia a partir de biomassa, e
considerando-se o calor específico da água 4,2Jg−1
K−1
, é
correto afirmar:
A água pesada, D2O(ℓ), é um líquido, à temperatura ambiente, utilizado na refrigeração de alguns tipos de reatores nucleares.
Em relação a essa informação, é correto afirmar:
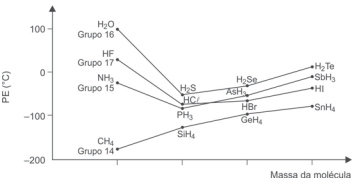
O gráfico mostra a variação do ponto de ebulição de hidretos covalentes líquidos de alguns elementos químicos dos grupos 14, 15, 16 e 17 da Tabela Periódica, em função da massa molecular.
Uma análise desse gráfico permite corretamente afirmar:
Pouco se conhece sobre as propriedades do elemento químico astato, 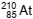 , em razão da raridade e da alta radioatividade
desse halogênio. Entretanto, é possível fazer previsões com base nas tendências entre as propriedades dos elementos
químicos desse grupo periódico.
, em razão da raridade e da alta radioatividade
desse halogênio. Entretanto, é possível fazer previsões com base nas tendências entre as propriedades dos elementos
químicos desse grupo periódico.
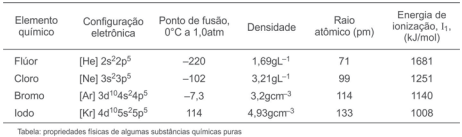
Considerando-se as informações da tabela e as tendências entre as propriedades dos elementos químicos do grupo 17 da
tabela periódica, é correto afirmar:
A crise econômica na Europa levou a União Europeia a tomar medidas drásticas de redução e contenção de gastos públicos, que causou impacto à vida do cidadão europeu. Em Portugal, o povo resolveu vender parte do ouro acumulado em joias e em objetos ao longo dos últimos quinhentos anos. Só em um mês, Portugal comercializou sete toneladas de ouro reciclado na forma pura de 24 quilates, p.e. 1064ºC ou de 18 quilates, na forma de liga.
A partir dessas informações e com base nas propriedades químicas e periódicas do elemento químico ouro, é correto afirmar:
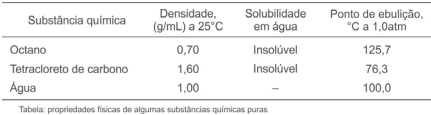
A obtenção de substâncias puras a partir de misturas tem sido um dos grandes desafios da Química, pois depende desde a escolha do método de separação adequado ao tipo de mistura, até mesmo das condições materiais e econômicas, e do tempo gasto na separação de componentes.
Levando-se em consideração essas informações, os dados apresentados na tabela de propriedades físicas e a mistura
formada entre os três líquidos, é correto afirmar:
A identificação de substâncias químicas tem como base a investigação da composição e de suas propriedades, as quais podem ser classificadas como extensivas e intensivas, como toda propriedade da matéria.
Considerando-se essas informações na identificação de substâncias químicas, é correto afirmar:
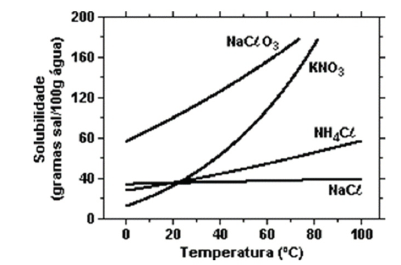
A 50ºC, uma solução aquosa saturada de um sal inorgânico revelou conter cerca de 128,4 g do sal para 85,6 g de água. Nesse caso, pode-se afirmar que o sal é o: