Questões de Concurso
Foram encontradas 8.680 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.
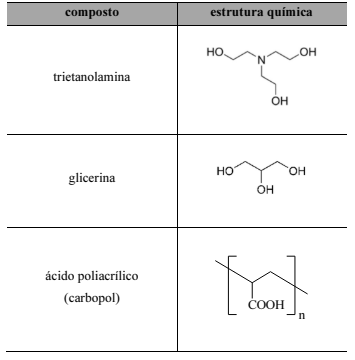
Entre os compostos trietilamina e trietanolamina, a trietilamina é mais facilmente solubilizada em uma solução aquosa de álcool a 70% que a trietanolamina.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.

Em solução fortemente ácida, os grupos carboxila do carbopol encontram-se majoritariamente ionizados.
O álcool em gel é principalmente composto de uma solução aquosa de álcool etílico a 70% (em massa). Para que o produto adquira a consistência de gel, são adicionados à formulação polímeros carbômeros, como o ácido poliacrílico, e outros compostos, como a trietanolamina, a glicerina e o álcool isopropílico (propan-2-ol). A próxima tabela apresenta a estrutura molecular de algumas dessas substâncias.

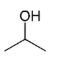
A estrutura química do álcool isopropílico é a seguinte.
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
É correto concluir que a massa de propano necessária para fornecer 350 kJ é superior a 7 g.
C3H8(g) + 5 O2(g) ⇌ 3 CO2(g) + 4 H2O(l) ΔHc° = 2.220 kJ
Tendo as informações precedentes como referência inicial, julgue o próximo item.
A entalpia de formação do propano pode ser obtida pela diferença entre ΔHc° e a soma das entalpias padrão de formação dos produtos da reação de combustão mostrada.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

A liga metálica aço inoxidável, material resistente à corrosão, é uma mistura homogênea formada, principalmente, por átomos de ferro e carbono.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Considere-se que, no processo de galvanização, o ferro seja coberto por uma camada de zinco. Nessa situação, o zinco é chamado de metal de sacrifício, pois será oxidado primeiro, porque apresenta maior potencial de oxidação que o ferro.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Na célula eletroquímica representada a seguir, ocorre redução do hidrogênio.
Pt(s), H2(g) | HCl(aq) ‖ Hg2Cl2(s) | Hg(l)
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Entre os metais apresentados na tabela, o ferro é o mais facilmente oxidável.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

Em uma pilha cujo eletrodo padrão de hidrogênio fosse acoplado a uma semicélula que contivesse o eletrodo de cobre, o hidrogênio funcionaria como cátodo da pilha.
Nos estudos de Alessandro Volta, que tomou como base os experimentos e as teorias de Galvani, foram utilizados diferentes discos de metais (Cu/Sn ou Zn/Ag) empilhados e conectados com pedaços de papel umedecidos em solução salina. Dessa maneira, o cientista conseguiu encontrar o método para a geração de corrente elétrica e estabeleceu evidências para a existência da eletricidade por meio da construção da pilha — cujo nome vem do empilhamento dos discos. Na tabela a seguir, são mostrados os potenciais padrão de redução de algumas espécies químicas em água.

A partir do texto apresentado, julgue o item seguinte.
É correto concluir que, na pilha montada por Alessandro
Volta, a quantidade de cobre metálico aumentou e a
concentração de íons Zn+2 diminuiu na solução ao longo da
reação.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
O anidrido bórico é um óxido obtido a partir da retirada total de moléculas de água da estrutura do ácido bórico e possui fórmula molecular BO3.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
Segundo Arrhenius, o ácido bórico forma uma solução eletrolítica porque é capaz de se ionizar na presença de água, formando íons livres em solução.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
A reação de neutralização parcial entre o ácido bórico e o hidróxido de cálcio na proporção de 1:1 pode formar o mono-hidrogenoborato de cálcio e duas moléculas de água.
Internet: <g1.globo.com> (com adaptações).
Considerando as informações do texto anterior, julgue o item subsequente.
O ácido bórico possui geometria trigonal plana em relação ao átomo de boro, e o ângulo observado nas ligações entre esse átomo e os átomos de oxigênio é de 120°.
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
Água e óleo são classificados como miscíveis, por isso uma mancha de óleo presente em um tecido não pode ser removida somente pela água.
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
O etanol é classificado como uma molécula anfótera, já que se dissolve em meios polares e apolares.
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
As forças de atração tendem a ser mais fortes no estado sólido que no estado líquido, o que faz a velocidade molecular também ser maior nos sólidos que nos líquidos.
Internet: <qnesc.sbq.org.br> (com adaptações).
A partir do texto apresentado, julgue o item a seguir.
A ligação de hidrogênio é a interação intermolecular mais forte que há, por isso a água, mesmo sendo uma molécula de baixa massa molecular, possui elevada temperatura de ebulição.