Questões de Concurso Comentadas para químico
Foram encontradas 863 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
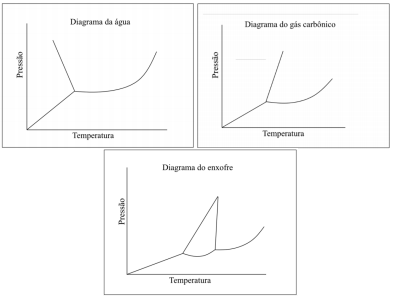
A água é um composto que apresenta um equilíbrio da fase líquido-sólido anômalo, conforme visto nos diagramas. Essa singularidade, em relação aos demais compostos, deve-se:
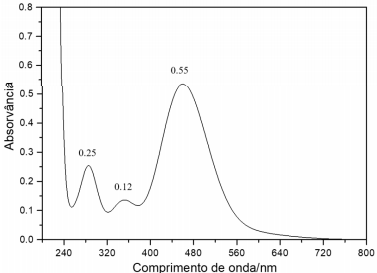
Esse espectro está relacionado com a seguinte tabela:
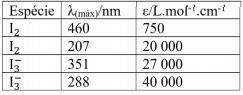
É sabido que uma solução aquosa de iodo apresenta equilíbrio químico com uma impureza de iodeto e forma o íon tri-iodeto, assim a pesagem direta não fornece informações suficientes para encontrar a concentração dessa espécie. Conhecendo as absortividades molares e a absorvância do experimento, a concentração de iodo é: (Dados: caminho óptico da cubeta = 1 cm)
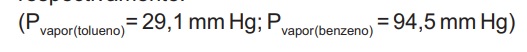
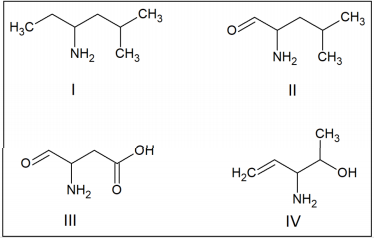
O tempo de retenção desses compostos com a fase estacionária está relacionado com as forças intermoleculares, ou seja, polaridades semelhantes serão fortemente atraídas. Sabendo que a fase estacionária está saturada de água, o composto retido por mais tempo é o:
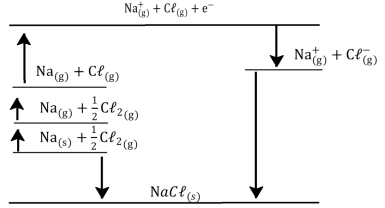
energia de ionização do Na = + 496 kJ.mol – 1 afinidade eletrônica do Cℓ = + 349 kJ.mol – 1 entalpia de atomização Na = + 107 kJ.mol – 1 entalpia de atomização Cℓ = + 122 kJ.mol entalpia padrão de formação do NaCℓ = – 411 kJ.mol – 1
A entalpia de rede do cloreto de sódio é: