Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Mn2+ (aq) + H2 O(l) → MnO2(s) + 4 H+ (aq) + 2e
Com base no experimento apresentado e no seu resultado, uma conclusão correta sobre o eletrodo onde se depositou o MnO e sobre o valor percentual mais próximo de Mn na amostra é que o eletrodo foi o
Dado: MMnO = 71 g mol-1 MMn = 55 g mol-1
Ca2+ + Polímero ⇌ [Ca-Polímero]
A resposta do sistema potenciométrico, em volts, em função da concentração de Ca2+ na solução de amostra, em mol L-1 , é modelada pela equação:
Esistema = 0,560 + 0,060 log[Ca2+ ] solução medida
Se o sinal medido de uma amostra foi 0,440 V, a concentração de Ca2+ na amostra, em mol L-1 , é
O valor mais próximo da pressão de vapor dessa solução, em mmHg, é
Dado: Pressão de vapor do etanol puro = 44 mmHg a 25º C Pressão de vapor da água pura = 18 mmHg a 25º C M (água) = 18,00 g mol-1 M (etanol) = 46 g mol-1
O reagente que ele deve escolher é o
O 60Co é isótono do nuclídeo
Dado: Número atômico do Mn = 25 Número atômico do Fe = 26 Número atômico do Co = 27 Número atômico do Ni = 28 Número atômico do Cu = 29
Esse processo químico
São características do sistema galvânico e do sistema corrente impressa, respectivamente:
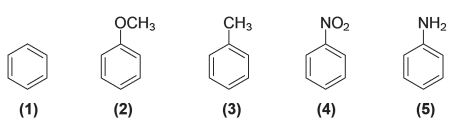
A ordem crescente de reatividade desses compostos em reações de SEAr é
Qual a massa de CO2, em gramas, produzida na combustão completa de 370 mg de varfarina?
Dado: massa molecular da varfarina = 308 g mol-1 massa molecular do CO2 = 44 g mol-1
Abaixo estão representadas quatro estruturas.
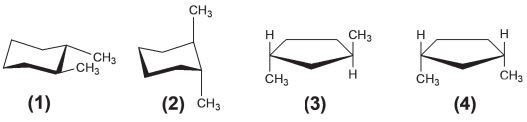
As estruturas
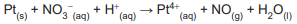
A soma dos coeficientes estequiométricos de reagentes e produtos na reação balanceada é
I - O calor liberado na hidrogenação do benzeno é menor que o liberado na hidrogenação de um trieno não aromático.
II - O benzeno sofre reações de adição de bromo (Br2 ) nas suas duplas ligações.
III - Segundo a Teoria do Orbital Molecular (TOM), o benzeno possui três orbitais moleculares π ligantes preenchidos com elétrons, além de apenas um orbital molecular antiligante.
IV - Por possuir ligações duplas e simples, há ligações carbono-carbono com diferentes comprimentos no benzeno.
Está correto APENAS, o que se afirma em
Analise a reação representada a seguir, na qual o produto formado não é apresentado.
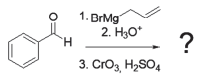
Qual o produto formado nas condições acima?
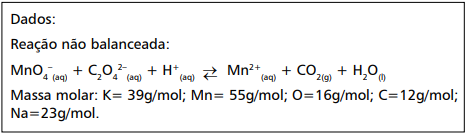
A molaridade dessa solução de KMnO4 é
Dados: Log 9,9 = 0,99
SO3(g) +H2SO4(l) → H2 S2 O7(l) (Equação1) H2S2O7(l) + H2O(l) → 2H2 SO4(l) (Equação2)
CAMPOS, R. V. Ácico Sulfúrico. Rev. Virtual Quim. 2011, 3(3), 210-214 (adaptado).
Para a produção do ácido sulfúrico 98% m/m, a indústria partiu de 800kg de SO3 e 980kg de H2SO4, além de água o suficiente para obtenção desse produto. A massa de ácido sulfúrico 98% m/m que se pode obter, em kg, é
Dados: Massa molar: O=16g/mol; H=1g/mol; S=32g/mol
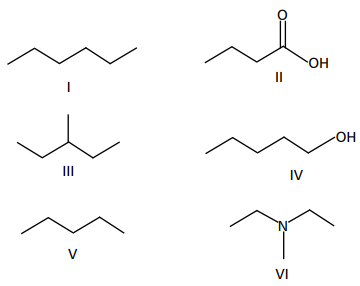
Em relação às propriedades físico-químicas dos compostos, é INCORRETO afirmar que
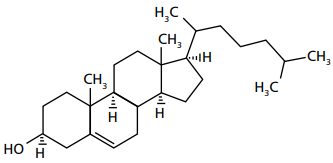
Sobre a estrutura acima, analise se as afirmativas são verdadeiras (V) ou falsas (F):
( ) Apresenta a função fenol. ( ) Apresenta isomeria óptica. ( ) Possui quatro centros de quiralidade. ( ) Possui baixa solubilidade em água. ( ) É um composto meso.
A sequência correta é
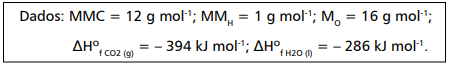
Considerando essas informações, o calor de formação estimado para a glicose, em kJ mol-1, é