Questões de Concurso
Para seeduc-rj
Foram encontradas 807 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dados: 1 mol de elétrons = 96500 C (1 F), massa molar do Al = 27g.mol -1
Dados: massas molares (g.mol -1 ), Ba=137, C=12, O=16, S=32

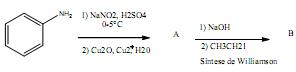
A fórmula estrutural correta do composto B é:
Dados de Kps :
BaCO3 = 5,0.10-9 ,
MnCO3 = 5,0.10-10 ,
Ag2 CO3 = 8,1.10-12 ,
ZnCO3 = 1,0.10-11
I – propan-1-ol
II – etoxietano
III – propanona
IV – propan-2-ol
V – butano
Aquele que apresenta o maior valor de ponto de ebulição é o composto representado por:

I – NaCl II – KBr III – MgCl 2 IV – AlCl 3 V – LiF
Dado: pKa do ácido acético = 4,74
1ª etapa: (CH3 )3 Br → (CH 3) 3C+ + Br - (I)
2ª etapa: (CH3 )3 C+ + OH- → (CH3 )3 COH (II)
Um per?l de reação genérico (esboçado) do processo é indicado no grá?co que segue:

equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520°C, é aproximadamente igual a :
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa reação, adiciona-se água e obtém-se uma substância A, que torna vermelho o papel azul de tornassol. Em outro erlenmeyer, faz-se a combustão do magnésio, adiciona-se água e obtém-se uma substância B, que torna azul o papel vermelho de tornassol. Em seguida, promove-se a reação entre A e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
A energia de ativação para a reação de decomposição pode ser calculada a partir da tabela e seu valor, em kJ.mol -1 , é aproximadamente igual a:
Dados: R= 8,31 J.mol -1. k-1 , ln 4,4 = 1,48; ln 3,5 = 1,25
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida em HCl e completou-se o volume até 100,00 mL de solução. Uma alíquota de 25,00 mL foi transferida para um balão, seguida da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3. Um excesso de KBr foi adicionado para formar Br2, segundo a equação a seguir: BrO3– + 5Br – + 6H+ → 3Br2 + 3H2O
O bromo formado reage com toda a sulfanilamida presente no antibiótico e, após um tempo, é adicionado excesso de KI, para reagir com o excesso de bromo, formando I2. Finalmente, o iodo formado é titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1 de tiossulfato de sódio. As demais equações químicas são:
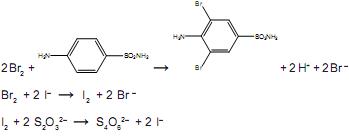
A porcentagem de sulfanilamida presente na amostra do antibiótico em pó é aproximadamente igual a:
Dado: Massa molar da sulfanilamida= 172 g. mol -1
A atividade biológica de compostos quirais pode variar muito de um enantiômero para outro. O caso mais célebre ocorreu com a talidomida, que causou defeitos congênitos (teratogênese) em fetos de grávidas que fizeram uso de medicamentos contendo misturas de seus isômeros ópticos, cujas estruturas estão indicadas a seguir:
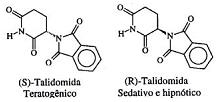
Considere um medicamento que continha um excesso enantiomérico de 50%, em relação ao isômero (R). Pode-se afirmar, então, que a composição percentual da mistura era igual a: