Questões de Concurso Para ufpi
Foram encontradas 1.649 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. Os efluentes não poderão conferir ao corpo receptor características de qualidade em desacordo com as metas obrigatórias progressivas, intermediárias e final do seu enquadramento;
II. O estudo de capacidade de suporte deve considerar, no mínimo, a diferença entre os padrões estabelecidos pela classe e as concentrações existentes no trecho desde a montante, estimando a concentração após a zona de mistura;
III. É vedado, nos efluentes, o lançamento dos Poluentes Orgânicos Persistentes - POPs, observada a legislação em vigor;
IV. O lançamento de efluentes em corpos de água, com exceção daqueles enquadrados na classe especial, não poderá exceder as condições e padrões de qualidade de água estabelecidos para as respectivas classes.
Assinale a opção CORRETA:
Na sequência o iodo foi titulado com tiossulfato de sódio a 0,100 mol/L até o ponto final, com o gasto de 30,00 mL de titulante. Esta última reação foi: I2 + 2 S2O2-3(aq) ➝ 2 I-(aq) + S4O2-6(aq).
Diante das informações, assinale a opção que mostra A PORCENTAGEM EM MASSA DE ZINCO NA AMOSTRA de latão: Dados: massas molares (g/mol): Cu = 63,5; Zn = 65,4.
I. A uma temperatura fixa, uma solução aquosa saturada de um determinado soluto sempre contém uma quantidade fixa desse soluto;
II. Todos os líquidos fervem a uma temperatura superior ao seu ponto de ebulição normal quando contêm impurezas não voláteis;
III. Toda solução comporta-se como uma solução ideal.
Com base na análise dos itens I, II e III, assinale a opção CORRETA:
Figura: Curvas dos valores de frações em mol para: ácido carbônico - linha pontilhada; bicarbonato - linha tracejada; carbonato - linha sólida.
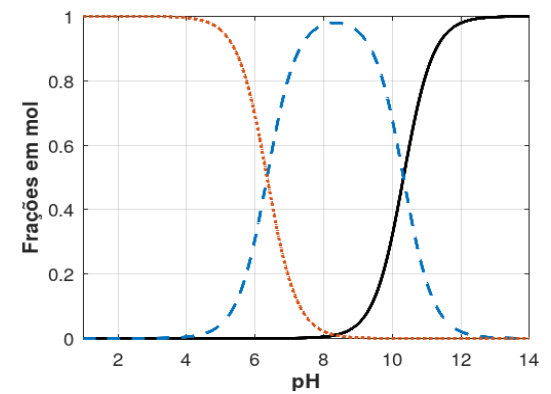
A partir das informações acima e sabendo que o Kps (constante produto de solubilidade) do CaCO3(s) (Calcita) é 4,5 x 10-9 , a 25°C , assinale a opção que mostra o valor aproximado da SOLUBILIDADE MOLAR deste carbonato, em pH 10: Dados eventualmente necessários:√4,5 = 2,12; √6,25 = 2,5; √3 = 1,73; √5 = 2,24; √10 = 3,16; √20 = 4,47.