Questões de Concurso
Para professor - química
Foram encontradas 4.185 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
De acordo com a afirmativa, assinale a opção que indica o objeto de conhecimento ligado ao terceiro eixo do currículo de Tecnologia para Aprendizagem.
A cultura maker, também chamada de movimento maker, parte do princípio de que pessoas comuns realizam ações de forma individual ou coletiva e buscam a solução de problemas ou a execução e viabilização de suas ideias e planos.
De acordo com o fragmento acima, a cultura maker também é conhecida como
Assinale a opção que apresenta a frase em que houve uma substituição inadequada de uma oração reduzida por uma forma nominalizada.
Sobre esse processo didático, assinale a afirmativa incorreta.
A esse respeito, assinale a opção ortograficamente correta.
Assinale a frase em que essa estratégia está identificada corretamente.
Assinale a opção em que o referente é identificado como referente extratextual conhecido.
Assinale a frase que mostra a inclusão indevida de uma dessas expressões.
Foi no Instituto de Letras da UFF, há alguns anos. Convidado, fez lá conferência um ex-Ministro de Angola. O assunto já não me lembra... Em todo caso, o tema é de somenos. Terminada a fala, com as palmas rituais, pôs-se o orador às ordens, para perguntas. À questão das línguas respondeu que, desgraçadamente, a oficial era a do colonizador, acreditando ele que essa anômala situação ainda duraria um século.
Assinale a opção que apresenta o tipo de preconceito linguístico a que esse fragmento textual se refere.
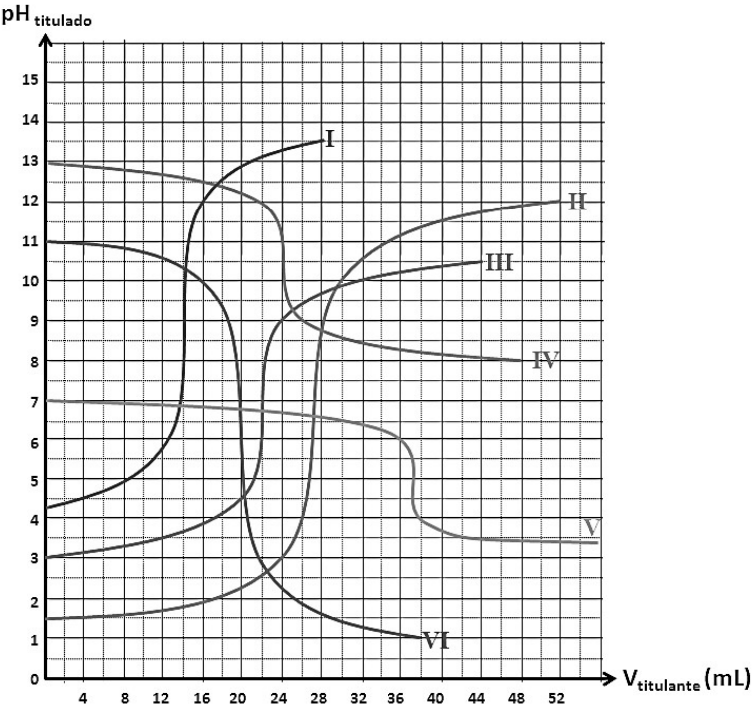
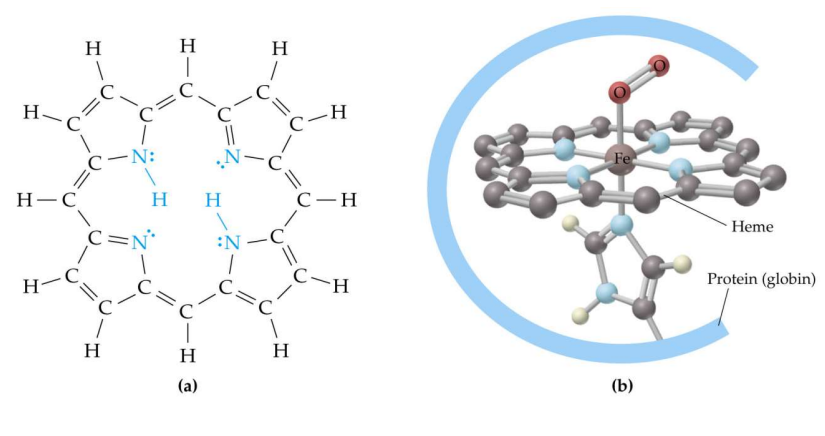
Sendo que Kd é a constante de dissociação, [Hb] a concentração de hemoglobina livre e [Hb]t , a concentração total de hemoglobina, pode-se afirmar corretamente que a relação entre a concentração de hemoglobina oxigenada e a hemoglobina total pode ser dada por
Fonte: http://www.cesadufs.com.br/ORBI/public/uploadCatalago/14413530102012Quimica_I_Aula_05.pdf.
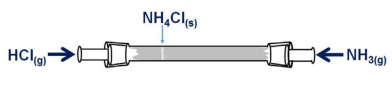
Assim, sendo a velocidade de difusão do cloreto de amônio igual a 27 km/min, pode-se determinar que a velocidade de difusão do HCl no sistema de Graham mostrado acima é