Questões de Concurso
Para professor - química
Foram encontradas 4.185 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
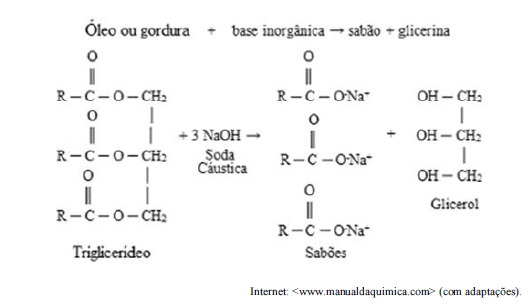
Com relação à reação de saponificação mostrada no texto anterior, assinale a opção correta.
A partir dessa informação, considere que uma pessoa com massa corporal de 70 kg tenha doado sangue em um hemocentro. Sabendo-se que M (C6H12O6) = 180 g/mol, que o volume retirado de sangue correspondeu a 9 mL/kg e que o nível de glicose nesse sangue é de 0,80 mg/mL, é correto afirmar que foram doados por este paciente
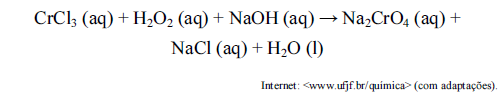
A respeito da reação de oxirredução não balanceada citada no texto acima, assinale a opção correta.
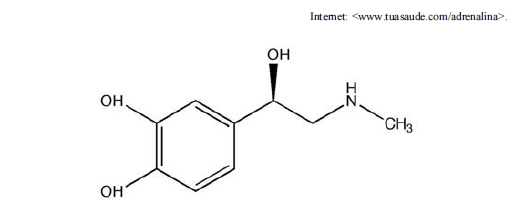
Considerando-se a fórmula estrutural da adrenalina, representada na figura precedente, é correto afirmar que o número de ligações sigma e pi presentes em uma molécula de adrenalina corresponde, respectivamente, a
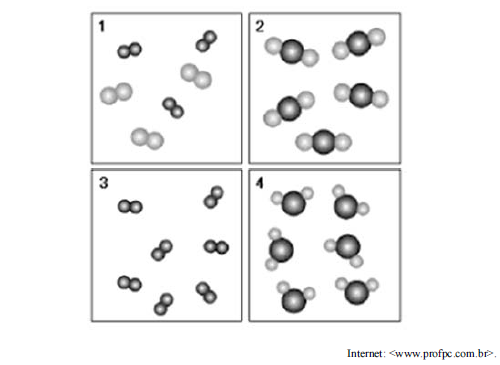
A figura precedente representa 4 sistemas formados por moléculas, em que bolinhas de cores diferentes representam átomos de elementos diferentes, e bolinhas juntas, que os átomos estão ligados entre si. Assinale a opção correta, de acordo com essa figura.
Internet: <brasil.elpais.com> (com adaptações).
A esse respeito, assinale a opção correta.
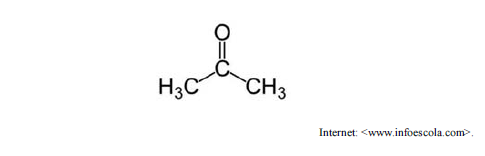
A propanona, cuja fórmula estrutural é mostrada anteriormente, é um composto orgânico que pertence à função das cetonas. Esse solvente é comercializado como acetona, um removedor comum de esmaltes utilizado em salões de beleza. A respeito da propanona, é correto afirmar que o carbono da carbonila possui geometria
Assinale a opção que apresenta duas variedades alotrópicas de estrutura cristalina.
TE (H2O) = +100 °C TE (H2S) = −60 °C
Essas diferenças entre as temperaturas de ebulição das substâncias podem ser explicadas pela(o)
( ) - Não é possível inserir um comentário na área de cabeçalho ou de rodapé de um documento. ( ) - Para imprimir documento sem imprimir os comentários no Microsoft Word 2010, basta clicar em Mostrar Marcações no grupo Controle e desmarcar a caixa de seleção comentários. ( ) - Para responder a um comentário no Microsoft Word 2010 ou 2007, basta clicar em Controlar Alterações no grupo Controle. ( ) - Para ver o nome do autor, a data e a hora em que o comentário foi feito, é só acionar Verificar Acessibilidade no grupo Acessibilidade. ( ) - Um comentário é uma anotação ou anotação que um autor ou revisor pode adicionar a um documento, exibido no painel de revisão ou em um balão na margem do documento.
A sequência CORRETA das afirmações é:
A respeito da energia livre de Gibbs, quando um processo ocorreu à pressão e temperatura constantes, um químico fez as seguintes ponderações:
I. Se a variação da energia livre de Gibbs for negativa, a reação química será espontânea num sentido direto da equação química. II. Se a variação da energia livre de Gibbs for nula, a reação química será não espontânea num sentido direto da equação química. III. Se a variação da energia livre de Gibbs for positiva, a reação inversa será espontânea.
Estão corretas as ponderações
Zn (s) → Zn2+ (aq) + 2e- Eº = +0,76 V
Inicialmente, na semicélula 1, a concentração da solução de íons zinco era igual a 1,5 mol/L e, na semicélula 2, a concentração de íon zinco era igual a 0,5 mol/L.
Dado: log3 = 0,5
Com base nessas informações, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) No eletrodo da semicélula 2, encontra-se o catodo da pilha. ( ) No eletrodo da semicélula 1, encontra-se o polo negativo. ( ) A força eletromotriz da pilha é aproximadamente 0,75 V. ( ) Possivelmente, a pilha não funcionará, porque os eletrodos são um único elemento.
Assinale a sequência correta.
Sobre os resíduos perigosos e suas propriedades, relacione a COLUNA II com a COLUNA I, associando o processo de tratamento com a metodologia empregada.
COLUNA I
1. Tratamento químico 2. Tratamento físico-químico 3. Tratamento biológico
COLUNA II
( ) Adsorção por carvão ativado ( ) Lodos ativados ( ) Precipitação de metais
Assinale a sequência correta.
Um estudante misturou, acidentalmente, dois frascos de solução aquosas básicas, uma de 300 mL de hidróxido de sódio 0,2 mol/L e outra de 100 mL de hidróxido de potássio.
Considerando que a concentração de íons hidróxidos na mistura foi de 0,3 mol/L, é correto afirmar que a razão entre as concentrações, em mol por litro, dos íons K+ e Na+ após a mistura é igual a
Nesse caso, é correto afirmar que o tipo de reação e o reagente utilizado para essa reação são, respectivamente,
Quando o operador, na leitura de certo volume de uma bureta, posiciona seus olhos abaixo da linha de aferição do volume que está medindo, a leitura que ele fará será de um volume
Supondo que não há mudança de volume com a adição do hidróxido de sódio e que a temperatura da solução, durante todo o processo reacional, permanece a 25 ºC, o químico chegou às seguintes conclusões:
I. O hidróxido de magnésio precipita primeiro que o hidróxido de cálcio. II. A concentração de íon magnésio que permanece na solução quando hidróxido de cálcio começa a precipitar é muito pequena. III. Não é necessário mais do que 0,06 mol/L de hidróxido de sódio para precipitar os dois íons na solução.
Dados: Kps (Mg(OH)2 ) = 1,1 x 10–11;
Kps (Ca(OH)2 ) = 5,5 x 10–6
Estão corretas as conclusões