Questões de Concurso
Para engenheiro júnior - processamento
Foram encontradas 135 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
C4H6O3 + H2 O → 2 CH3COOH
A reação deverá produzir 20 kg/h de ácido acético, a constante de velocidade é aproximadamente 0,05 min-1 , a concentração inicial de anidrido acético é de 100 g/L, e a conversão, de 80%.
O volume aproximado, em litros, desse reator é
Dados Massa Molar do Ácido Acético (CH3COOH) = 60 g/mol Massa Molar do Anidrido Acético (C4H6O3 ) = 102 g/mol
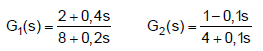
Para controle dessas malhas, um engenheiro deve levar em consideração vários fatores, como estabilidade, margem de fase, ganho, entre outros.
Nesse caso, em relação às funções de transferência G1(s) e G2(s), tem-se o seguinte:
da = –sdT – Pdv
Utilizando-se as relações de Maxwell e a equação de estado do gás ideal (PV = RT), a relação (∂s/∂v)T para um gás ideal é
Em uma etapa posterior, o reagente em excesso que não participou da reação é recuperado, sendo completamente separado do produto formado. A vazão de reagente recuperado, em kg h-1, é igual a
Dado Massas molares: C2H4 : 28 g mol-1, H2 : 2g mol-1
A corrente X é encaminhada para a segunda etapa, sendo separada em duas novas correntes: W e Z. A corrente W tem vazão de 80 kg h-1 e contém 95% de A. Por sua vez, a corrente Z tem vazão de 20 kg h-1 e contém 20% de A.
A concentração percentual de A na corrente de alimentação é igual a