Questões de Concurso
Para química
Foram encontradas 13.129 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
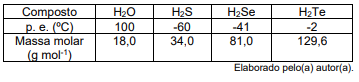
A justificativa que responde a variação do ponto de ebulição para os calcogenetos de hidrogênio é que a substância
Dados: pH = -log [H3O+] Constante de autoionização da água, Kw = 1,0 x 10-14
Considere uma reação do tipo A + B → C + D, sobre a qual foram coletados os dados abaixo:
Concentração inicial de A (mol/L) |
Concentração inicial de B (mol/L) |
Velocidade inicial da reação (mol/Lmin) |
0,05 |
0,10 |
0,025 |
0,10 |
0,10 |
0,050 |
0,05 |
0,20 |
0,050 |
Qual alternativa apresenta corretamente a ordem global e a constante de velocidade da reação?
A célula eletrolítica para purificação do cobre contém solução de sulfato de cobre (CuSO4), o material a ser purificado em um dos eletrodos e outro eletrodo onde se depositará o cobre puro, como representado a seguir:
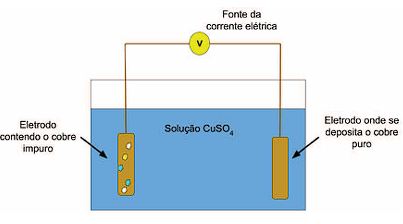
Disponível em: <https://www.saofranciscodeassis.edu.br/rgsn/arquivos/RGSN04/Refino-do-cobre-por-meio-daeletr%C3%B3lise-DAROSCI-OLIVEIRA-p171-182.pdf> (Com adaptações). Acesso em: 17 abr. 2024.
Sobre essa metodologia, é correto afirmar que:
Em uma aula de graduação para estudantes do curso de Química, é solicitado que os alunos obtenham furfural a partir de resíduo de cravo da índia. Para isso, o resíduo é tratado com ácido, e o material é submetido a uma destilação simples, onde o destilado contém o material de interesse.
Para isolar o furfural, os alunos devem realizar uma extração líquido-líquido. Em um funil de separação, adiciona-se o destilado aquoso e, em seguida, o solvente orgânico, no caso diclorometano. Após leve agitação, o funil é deixado em repouso e duas fases se formam, como representado na figura a seguir:
Dados:
Densidade da água = 1g/cm³
Densidade do diclorometano = 1,33 g/cm³
Coeficiente de distribuição: KD = Concentraçãofase orgânica/Concentraçãofase aquosa > 1
Sobre o procedimento descrito, qual das alternativas apresenta uma afirmação correta?
Em uma turma de Ensino Médio, o professor resolveu confeccionar uma bateria com materiais de baixo custo, para fins didáticos. Utilizando recipientes coletores, pregos galvanizados, pedaços de grafite e tintura de iodo contendo um pouco de iodeto de potássio, três células galvânicas foram montadas e associadas em série, como visto na figura abaixo:
Os alunos foram convidados a medir a tensão gerada pela bateria com auxílio de um multímetro.
DE ARAÚJO, Sayonara Maria Ferreira et al. Confecção de celas galvânicas com materiais de baixo custo para otimização de aulas sobre reações de oxirredução e eletroquímica no ensino médio. (Com adaptações).
Dados:
Potenciais de redução nas condições em que a bateria foi confeccionada:
I3- + 2e- → 3I- E = 0,53V
Zn+2 + 2e- → Zn E = -0,76V
Qual é o valor mais próximo do esperado para a bateria descrita?
Os gráficos abaixo são referentes a uma reação do tipo A → B + C.
No primeiro gráfico, temos a variação da concentração do reagente A em função do tempo de reação:
No segundo gráfico, temos a velocidade da reação em função do tempo:
Com base nos dois gráficos, o que é possível afirmar sobre a cinética da reação?
Em um laboratório químico, existem diversas vidrarias com diferentes funções e outras com funções similares, porém com diferentes níveis de precisão.
Assinale a alternativa que traz as vidrarias correspondentes à descrição a seguir:
São tubos calibrados que apresentam torneira, normalmente de teflon ou vidro. Capazes de dispensar volumes com precisão de acordo com a capacidade da vidraria.
Um químico observa que, durante a dissolução de um certo sal em água, o recipiente em que a solução está sendo preparada se resfria.
A explicação química mais coerente para esse fenômeno é:
Qual das alternativas apresenta um procedimento correto em caso de exposição a um produto químico perigoso?
Sobre o armazenamento seguro de produtos químicos, é incorreto afirmar que:
Em um recipiente fechado, são adicionados hidrogênio e nitrogênio, ambos no estado gasoso. No recipiente são ajustadas as condições para que o material reaja segundo a equação abaixo:
Keq
3H2(g) + N2(g) ⇄ 2NH3(g)
Depois de atingido o equilíbrio, a concentração de hidrogênio (H2(g)) é igual a 0,34 molL-1, e a de amônia (NH3(g)) é igual a 0,44 molL-1.
Dados: Keq = 6,1 mol-2L2
Qual a concentração de nitrogênio (N2(g)) no equilíbrio?