Questões de Vestibular
Sobre física térmica - termologia em física
Foram encontradas 953 questões

A figura precedente mostra um diagrama pressão versus volume que corresponde a uma transformação cíclica sofrida por um gás ideal. O ciclo é percorrido na seguinte sequência: A → B, B → C, C → D, D → A.
No ciclo termodinâmico completo, a variação de energia interna do gás é nula.
Um grupo de estudantes, em aula de laboratório de Física, mergulhou o resistor de um aquecedor elétrico, ligado a uma fonte de tensão de 120 V, em um recipiente, termicamente isolado, contendo água. Mediram a temperatura da água em função do tempo e verificaram que, em 2 minutos, a temperatura variou de 20°C a 80°C. A partir dos resultados obtidos, construíram o gráfico apresentado na figura abaixo, da quantidade de calor Q, em calorias, fornecida à água em função do instante t, a partir do mergulho do resistor na água, em minutos.
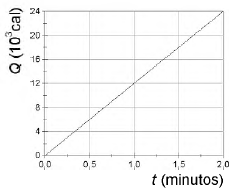
Os valores da resistência elétrica do aquecedor e da massa de água aquecida são, respectivamente, iguais a:
Dados
• 1 cal = 4 J
• calor específico da água = 1 cal/g °C
Fonte: https://www.embrapa.br/busca-de-noticias/-/noticia/1472703/piscicultores-buscam-adotar-tecnologia--que-pode-triplicar-producaode-peixe-no-am, acessado em: 14 de julho de 2016. (Adaptado)
Analisando-se um sistema de aeração, percebe-se que uma bolha de ar que ascende desde o fundo de um tanque de piscicultura, com temperatura constante, dobra seu volume desde sua formação até atingir a superfície da água. Considerando-se que o ar da bolha é um gás ideal e que a pressão atmosférica local é igual a 1 atm, a profundidade do tanque é, aproximadamente, igual a
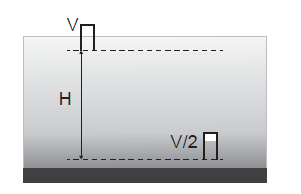
Este processo é lento, e a temperatura do copo e da água pode ser considerada como constante. Considerando o ar um gás ideal, calcule a profundidade H, em m.


Dados: patm =1,0 x 105 Pa ; págua = 1,0 x 103 kg/m3 g = 10 m/s2
I - Se o processo é isotérmico, a pressão final do gás é menor do que a pressão inicial. II - Se a temperatura final do gás é maior do que a inicial, o processo é isobárico. III - Se a pressão final do gás é maior do que a inicial, a temperatura final do gás é necessariamente maior que a temperatura inicial.
É correto o que se afirma em:
Para realizar um tratamento deve-se dar um banho num paciente com água a 37ºC. Utiliza-se nesse procedimento um chuveiro elétrico de resistência 22Ω, ligado a uma rede de 220V. (Considere para efeitos de cálculo, o calor específico da água c ≅ 4J/gºC, a densidade da mesma ρ = 1kg/litro e que toda a energia dissipada na resistência seja convertida em calor).
Sabendo-se que a temperatura ambiente é
de 27ºC, a vazão, em mililitros/s, que esse chuveiro deverá ter nessas condições, é:
Considere o caso abaixo e responda: Qual é a transformação sofrida pelo gás ao sair do spray?
As pessoas com asma, geralmente, utilizam broncodilatadores em forma de spray ou mais conhecidos como bombinhas de asma. Esses, por sua vez, preci-sam ser agitados antes da inalação para que a medicação seja diluída nos gases do aerossol, garantindo sua homogeneidade e uniformidade na hora da aplicação.
Podemos considerar o gás que sai do aerossol como sendo um gás ideal, logo, sofre certa transformação em sua saída.
Dentro de um calorímetro perfeito, de capacidade C = 40 cal/°C e temperatura inicial 0 °C, colocam-se 100 g de um material de calor específico 0,50 cal/g°C a uma temperatura de 90 °C, e uma massa de 10 g de gelo a 0 °C. Calcule, em °C, o valor da temperatura final de equilíbrio do sistema.
Dados:
CÁGUA = 1,0 cal/g°C
LFUSAO GELO = 80 cal/g
Quando necessário, adote:
• módulo da aceleração da gravidade: 10 m.s-2
• calor latente de vaporização da água: 540 cal.g-1
• calor específico da água: 1,0 cal.g-1. °C-1
• densidade da água: 1 g.cm-3
• constante universal dos gases ideais: R = 8,0 J.mol-1.K-1
• massa específica do ar: 1,225.10-3 g.cm-3
• massa específica da água do mar: 1,025 g.cm-3
• 1cal = 4,0 J
• Determine o volume de água, em litros, que deve ser colocado em um recipiente de paredes adiabáticas, onde está instalado um fio condutor de cobre, com área de secção reta de 0,138mm2 e comprimento 32,1m, enrolado em forma de bobina, ao qual será ligada uma fonte de tensão igual a 40V, para que uma variação de temperatura da água de 20K seja obtida em apenas 5 minutos. Considere que toda a energia térmica dissipada pelo fio, após sua ligação com a fonte, será integralmente absorvida pela água. Desconsidere qualquer tipo de perda.
Dado: resistividade elétrica do cobre = 1,72.10-8Ω.m
Quando necessário, adote:
• módulo da aceleração da gravidade: 10 m.s-2
• calor latente de vaporização da água: 540 cal.g-1
• calor específico da água: 1,0 cal.g-1. °C-1
• densidade da água: 1 g.cm-3
• constante universal dos gases ideais: R = 8,0 J.mol-1.K-1
• massa específica do ar: 1,225.10-3 g.cm-3
• massa específica da água do mar: 1,025 g.cm-3
• 1cal = 4,0 J
• O diagrama abaixo mostra um ciclo realizado por 1 mol de um gás monoatômico ideal. Determine, em porcentagem, o rendimento de uma máquina de Carnot que operasse entre as mesmas fontes térmicas desse ciclo.
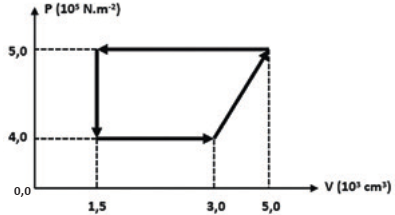
Quando necessário, adote:
• módulo da aceleração da gravidade: 10 m.s-2
• calor latente de vaporização da água: 540 cal.g-1
• calor específico da água: 1,0 cal.g-1. °C-1
• densidade da água: 1 g.cm-3
• constante universal dos gases ideais: R = 8,0 J.mol-1.K-1
• massa específica do ar: 1,225.10-3 g.cm-3
• massa específica da água do mar: 1,025 g.cm-3
• 1cal = 4,0 J
• Os filtros de “barro”, na verdade não são de barro, mas sim de cerâmica à base de argila. Esses filtros possuem pequenos poros que permitem a passagem lenta da água, do reservatório para a superfície externa, ocorrendo então a transformação da água do estado líquido para o estado de vapor. Essa transformação ocorre a partir do calor que a água da superfície externa absorve do filtro e da água em seu interior. A retirada do calor diminui gradualmente a temperatura da água que está dentro do filtro, tornando-a agradável para consumo.
Num dia de temperatura muito elevada e umidade do ar muito baixa, uma dona de casa enche com água seu filtro cerâmico à base de argila, que estava totalmente vazio, até a capacidade máxima de 6 litros. Decorrido certo intervalo de tempo, verifica-se que houve uma diminuição no volume total, devido à passagem de m gramas de água pelos poros da parede do filtro para o meio externo. Como consequência, ocorreu uma variação de temperatura de 5 kelvin na massa de água restante. Nessas condições, determine a massa de água m, aproximada, em gramas, que evaporou.

Quando necessário, adote:
• módulo da aceleração da gravidade: 10 m.s-2
• calor latente de vaporização da água: 540 cal.g-1
• calor específico da água: 1,0 cal.g-1. °C-1
• densidade da água: 1 g.cm-3
• constante universal dos gases ideais: R = 8,0 J.mol-1.K-1
• massa específica do ar: 1,225.10-3 g.cm-3
• massa específica da água do mar: 1,025 g.cm-3
• 1cal = 4,0 J
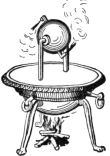
Figura 1 - Representação da máquina de Heron Fonte: Disponível em:<https://pt.wikipedia.org/wiki/Eol%C3%ADpila#/media/File:Aeolipile_illustration.png> . Acesso em: 08 set. 2017
Misturam-se dois líquidos em um calorímetro, de capacidade calorífica desprezível. O primeiro tem massa m1 = 80 g, c1 = 0,20 cal/(g.°C) e está a 80 °C. O segundo tem massa m2 = 160 g, c2 = 0,10 cal/(g.°C) e está a 40 °C.
Encontre a temperatura final de equilíbrio.
Considere as três afirmativas abaixo, em relação a um gás ideal.
I - Em uma compressão adiabática, a temperatura final do gás não pode ser maior do que a inicial, pois nenhum calor é trocado com a vizinhança.
II - Em um processo isocórico (isovolumétrico), nenhum trabalho é realizado pelo gás.
III - Em um processo isobárico, o trabalho realizado pelo gás é proporcional ao quadrado da variação do volume.
Marque a única opção CORRETA:
Três blocos metálicos de mesma massa possuem calores específicos c1 , c2 e c3 , e suas temperaturas iniciais são T1 = 0°C, T2 = 30°C e T3 = 20°C, respectivamente. Inicialmente colocam-se os blocos 1 e 2 em um calorímetro perfeito (com capacidade térmica desprezível) até que o equilíbrio térmico seja estabelecido, o que ocorre na temperatura de 10º C. O bloco 1 é, então, retirado do calorímetro e substituído pelo bloco 3. A temperatura final de equilíbrio entre os blocos 2 e 3 é de 15°C.
Calcule c3 , em cal/(g. °C).
Dado
c1
= 0,20 cal/(g.
°C)
Um calorímetro de capacidade térmica igual a 80 cal/°C está a uma temperatura de 40°C. Ao misturar, dentro desse calorímetro, uma massa de gelo M a 0°C e 70 g de água a 80°C, a temperatura de equilíbrio é 50°C.
Calcule a massa de gelo M em gramas.
Dados
cágua= 1,0 cal/(g.°C)
Lfusão= 80 cal/g.
Dados
cágua = 1,0 cal/(gº C)
Lfusão = 80 cal/g