Questões de Vestibular
Sobre física térmica - termologia em física
Foram encontradas 942 questões

Na figura precedente é ilustrada a situação em que um bloco de 1 kg de gelo, a uma temperatura inicial de 0 ºC, é colocado em um recipiente para receber calor de uma chama. A potência de transferência de calor da chama para o gelo é de 10 W. A chama é a única fonte de calor recebida pelo gelo.
A temperatura do gelo escola a subir imediatamente após a chama ser acesa e começar a transferir calor para o gelo.

A figura precedente mostra um diagrama pressão versus volume que corresponde a uma transformação cíclica sofrida por um gás ideal. O ciclo é percorrido na seguinte sequência: A → B, B → C, C → D, D → A.
A respeito do diagrama, e considerando que 1 bar = 10 5 Pa e que 1 L = 10 -3 m 3 , julgue o próximo item.
Para um motor que obedeça ao ciclo em questão, o calor fornecido pela queima de combustível será igual ao trabalho realizado pelo motor.

A figura precedente mostra um diagrama pressão versus volume que corresponde a uma transformação cíclica sofrida por um gás ideal. O ciclo é percorrido na seguinte sequência: A → B, B → C, C → D, D → A.
A respeito do diagrama, e considerando que 1 bar = 10 5 Pa e que 1 L = 10 -3 m 3 , julgue o próximo item.
No ciclo termodinâmico completo, o trabalho realizado pelo gás é igual a 100 J.

A figura precedente mostra um diagrama pressão versus volume que corresponde a uma transformação cíclica sofrida por um gás ideal. O ciclo é percorrido na seguinte sequência: A → B, B → C, C → D, D → A.
No ciclo termodinâmico completo, a variação de energia interna do gás é nula.
Dentro de um calorímetro perfeito, de capacidade C = 40 cal/°C e temperatura inicial 0 °C, colocam-se 100 g de um material de calor específico 0,50 cal/g°C a uma temperatura de 90 °C, e uma massa de 10 g de gelo a 0 °C. Calcule, em °C, o valor da temperatura final de equilíbrio do sistema.
Dados:
CÁGUA = 1,0 cal/g°C
LFUSAO GELO = 80 cal/g
Misturam-se dois líquidos em um calorímetro, de capacidade calorífica desprezível. O primeiro tem massa m1 = 80 g, c1 = 0,20 cal/(g.°C) e está a 80 °C. O segundo tem massa m2 = 160 g, c2 = 0,10 cal/(g.°C) e está a 40 °C.
Encontre a temperatura final de equilíbrio.
Considere as três afirmativas abaixo, em relação a um gás ideal.
I - Em uma compressão adiabática, a temperatura final do gás não pode ser maior do que a inicial, pois nenhum calor é trocado com a vizinhança.
II - Em um processo isocórico (isovolumétrico), nenhum trabalho é realizado pelo gás.
III - Em um processo isobárico, o trabalho realizado pelo gás é proporcional ao quadrado da variação do volume.
Marque a única opção CORRETA:
Três blocos metálicos de mesma massa possuem calores específicos c1 , c2 e c3 , e suas temperaturas iniciais são T1 = 0°C, T2 = 30°C e T3 = 20°C, respectivamente. Inicialmente colocam-se os blocos 1 e 2 em um calorímetro perfeito (com capacidade térmica desprezível) até que o equilíbrio térmico seja estabelecido, o que ocorre na temperatura de 10º C. O bloco 1 é, então, retirado do calorímetro e substituído pelo bloco 3. A temperatura final de equilíbrio entre os blocos 2 e 3 é de 15°C.
Calcule c3 , em cal/(g. °C).
Dado
c1
= 0,20 cal/(g.
°C)
Um calorímetro de capacidade térmica igual a 80 cal/°C está a uma temperatura de 40°C. Ao misturar, dentro desse calorímetro, uma massa de gelo M a 0°C e 70 g de água a 80°C, a temperatura de equilíbrio é 50°C.
Calcule a massa de gelo M em gramas.
Dados
cágua= 1,0 cal/(g.°C)
Lfusão= 80 cal/g.
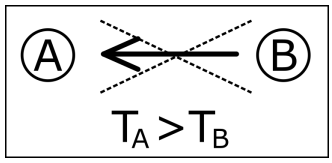

Nesse esquema o autor explica que “o calor espontaneamente não pode ir de um corpo para outro de temperatura mais alta". Essa afirmação está de acordo com a
Dado: R = 8,3 J/mol.K.
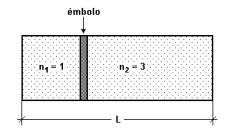
Em um dia de inverno, a temperatura ambiente está muito baixa. Com a finalidade de aquecer o ar do interior de uma pequena caixa que estava em contato com o ambiente, coloca-se dentro dessa caixa um objeto que está inicialmente a 100 °C. A tabela a seguir mostra 5 possibilidades para esse objeto:
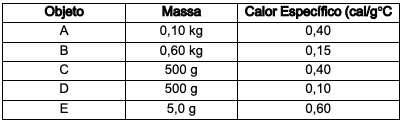
O objeto mais indicado para tal finalidade é: