Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 622 questões
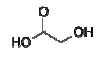 e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
ClCH2CO2H + NaOH → HOCH2CO2H + NaCl
Desta forma, alguns milhões de quilogramas de ácido glicólico são produzidos anualmente.
Calcule a quantidade de ácido glicólico produzida a partir de 200 g de ácido cloroacético e 70,0 g de hidróxido de sódio. Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; Na = 23; Cl = 35,5.
x Au(s) + y NO3− (aq) + w H+ (aq) + z Cl− (aq) → a AuCl4− (aq) + b H2O(l) + d NO(g)
Após balancear a equação acima com os menores números possíveis, correspondentes, a soma dos coeficientes estequiométricos será:
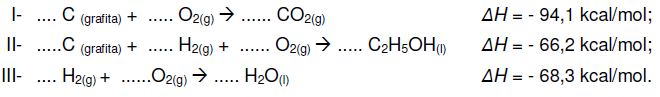
Sabendo-se que a variação de entalpia (∆H) de uma reação qualquer depende somente dos estados iniciais dos reagentes e do estado final dos produtos, marque a alternativa que corresponde aos coeficientes mínimos para a correta estequiometria das reações I, II e III, assim como a quantidade de calor produzida na combustão de 9,2 kg de álcool etílico líquido produzido [C2H5OH(l)], a partir dos coeficientes mínimos encontrados.
O trióxido de enxofre (SO3) é obtido a partir da reação do dióxido de enxofre (SO2) com o gás oxigênio (O2), representada pelo equilíbrio a seguir.
2 SO2(g) + O2(g) 2 SO3(g) ΔHθ = - 198 kJ
A constante de equilíbrio, KC, para esse processo a 1000o C é igual a 280. A respeito dessa reação, foram feitas as seguintes afirmações:
I. A constante de equilíbrio da síntese do SO3 a 200o C deve ser menor que 280.
II. Se na condição de equilíbrio a 1000o C a concentração de O2 é de 0,1 mol.L-1 e a concentração de SO2 é de 0,01 mol.L-1, então a concentração de SO3 é de 2,8 mol.L-1.
III. Se, atingida a condição de equilíbrio, o volume do recipiente for reduzido sem alteração na temperatura, não haverá alteração no valor da constante de equilíbrio, mas haverá aumento no rendimento de formação do SO3.
IV. Essa é uma reação de oxirredução, em que o dióxido de enxofre é o agente redutor.
• Estão corretas apenas as afirmações:


Dados: massas molares (g/mol): C = 12, Fe = 56 e Fe2O3 = 160.
