Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 614 questões
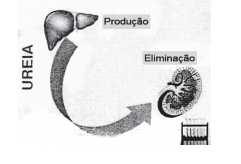
Diariamente, um homem elimina pela urina cerca de 30g de ureia (NH2 )2 ) CO, diariamente conforme a figura apresentada.
Com base nessas informações, o número de átomos de nitrogênio que são eliminados diariamente é igual a
A partir dessas informações e dos fatores que afetam a densidade de um material ou de uma substância química, é correto afirmar:
Cu2+(aq) + 2 e- ↠ Cu (s)
A quantidade de elétrons, em mols, necessária para a obtenção de 254g de cobre puro é
Barreiro, E.J.; Bolzani, V.S.; Biodiversidade: fonte potencial para a descoberta de fármacos, Quím. Nova, vol.32 (3), 2009. (adaptado).
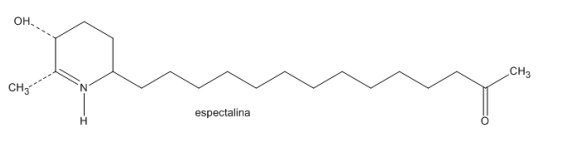
Com base na fórmula estrutural da espectalina mostrada abaixo, obtém-se a massa molar de:
Uma medalha, supostamente de ouro puro, foi testada pelo deslocamento do volume de água contido em uma proveta (recipiente cilíndrico de vidro graduado em cm3 ). Para isso, a medalha, cujo peso era de 57,9 gramas, foi colocada numa proveta de 50 cm 3 que continha 25 cm3 de água e mediu-se o volume de água deslocado na proveta. Sabendo-se que a densidade do ouro puro é de 19,3 g/cm3 , qual será o volume final lido na proveta em cm3 se a medalha for de ouro puro?
Assinale no cartão-resposta o resultado numérico encontrado.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
I. FeS2 + O2 → Fe2(SO4)3 + SO2
II. Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
III. H2SO4 + KNO3 → KHSO4 + HNO3
A partir da leitura do texto e da interpretação das equações, assinale com V ou F, conforme sejam verdadeiras ou falsas, as assertivas abaixo.
( ) A equação I traduz uma reação de deslocamento.
( ) A soma dos coeficientes da equação II é 13.
( ) Na equação III, existe um sal ácido.
( ) Na pirita, o nox do ferro é +2.
( ) Para produzir 94,5 kg de ácido nítrico, são necessários 121,5 kg de salitre.
( ) A equação II traduz uma reação de óxido redução.
A sequência correta, de cima para baixo, é:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Considerando as informações sobre o experimento acima descrito, assinale a única afirmação FALSA.
A densidade é uma propriedade física intensiva utilizada na identificação de substâncias. Matematicamente, a densidade de um determinado material ou de uma substância química é o resultado da divisão da massa pelo volume, que pode ser expresso em, g.cm−3 , em g.L−1 ou em kg.L−1 .
A partir dessas informações e dos fatores que afetam a densidade de um material ou de uma substância química, é correto afirmar:
Considere as seguintes afirmativas: I. A cana-de-açúcar é uma planta que pertence ao gênero Saccharum, família Poaceae, utilizada principalmente como matéria-prima para a produção de açúcar e etanol (álcool etílico). II. O etanol se forma na fermentação alcoólica de açúcares, como a glicose, pelo microrganismo (levedura) Saccharomyces cerevisiae, conforme a reação simplificada: C6H12O6 → 2 C2H6O + 2 CO2. III. Os coeficientes estequiométricos para a reação de combustão completa do etanol x C2H6O(l) + y O2(g) → w CO2(g) + z H2O(l), são: x = 1, y = 3, w = 2 e z = 3. IV. Na combustão completa de um mol de etanol ocorre a liberação de 402 kJ de energia.
Dados: Entalpia padrão de formação (ΔH0 f), em kJ·mol-1 , para: C2H6O(l) = -278; CO2(g) = -394 e H2O(l) = -286
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
- Líquido A: H2O
Nº de gotas / mL 20
- Líquido B: CH3CH2OH Nº de gotas / mL 50
- Líquido C: mistura H2O / CH3CH2OH Nº de gotas / mL 40
Um grupo de amigos percebe que, ao se gotejar um líquido sobre uma moeda, forma-se uma gota sobre essa moeda. Após adições sucessivas, a gota colapsa e o líquido espalha-se sobre a moeda. No entanto, eles verificam que, dependendo do líquido, o comportamento é diferente, mas o material da moeda não influencia. Assim, eles fazem um desafio para ver quem consegue utilizar o menor volume de líquido para cobrir toda a superfície da moeda, sendo que eles podem escolher entre os líquidos A, B e C e utilizar uma moeda de 5 ou 10 centavos.
Quem ganhou o desafio?
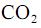 com
com 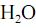 , fotocatalisada, resulte, exclusivamente, na formação de
, fotocatalisada, resulte, exclusivamente, na formação de 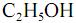 e
e 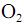 e que a densidade do
e que a densidade do 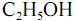 seja igual a 0,80 g/mL, calcule, em litros, o volume de
seja igual a 0,80 g/mL, calcule, em litros, o volume de 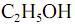 que seria formado a partir de 100,0 kg de
que seria formado a partir de 100,0 kg de 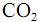 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos necessários.
. Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos necessários. 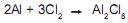
Pode-se afirmar que o reagente limitante, quando 20,0 g de Al e 30,0 g de Cl 2 são usados, e a massa em grama de cloreto de alumínio, teoricamente formada, são, respectivamente,
O índice de saponificação de uma amostra de óleo de macaúba, formada apenas por triglicerídeos, corresponde a 168,3 mg de KOH por g do óleo. Considerando uma completa saponificação, calcule, em gramas por mol, a massa molar média das moléculas do óleo dessa amostra. Divida o resultado encontrado por 2. Para a marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado final obtido, após ter efetuado todos os cálculos solicitados.