Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões
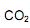 coletados no cubo é igual a:
coletados no cubo é igual a: 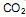 precisa ser retirado. Sabendo-se que o
precisa ser retirado. Sabendo-se que o 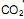 é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o
é um óxido ácido, esses trajes possuem um sistema de purificação do ar contendo basicamente hidróxido de lítio, substância que, em contato com o 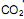 produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o
produz carbonato de lítio e água. Considerando que o traje espacial possui uma capacidade máxima de volume para expandir, além do corpo da pessoa, de 5,2 Litros, a temperatura e pressão constantes de 29ºC e 760 mmHg, respectivamente. Qual a massa de hidróxido de lítio necessário para retirar todo o 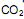 produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 )
produzido quando o traje atingir seu volume máximo? (Dado: R= 0,082 atm L mol -1 K-1 ) O chumbo é obtido da galena (PbS) através da sequência de reações não balanceadas, apresentadas a seguir.
x PbS(s) = y O2 (g) → z PbO(s) + w SO2(g)
PbS(s) + PbO(s) → Pb(s) + SO2(g)
A soma dos coeficientes estequiométricos representados por x, y, z e w resulta no seguinte valor:




A partir dessas informações, julgue o itens de 58 a 66, assinale
a opção correta no item 67 e faça o que se pede no item 68, que
é do tipo B.

Com a decomposição de 400kg de calcário, se emitem para a atmosfera
Considerando que a concentração do ácido derramado é de 98,00 % peso por peso e sua densidade é de 1,84 g/mL, calcule a massa aproximada de CaO necessária para neutralizar 1000 L do ácido derramado.
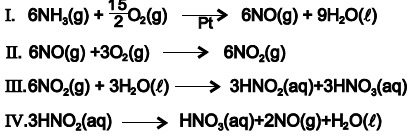
Com base nessas informações e de acordo com as equações químicas que representam o processo de fabricação do ácido nítrico, é correto afirmar:

Um airbag é uma bolsa que infla rapidamente e que, num acidente de carro, ajuda a prevenir lesões graves, como mostra a figura ao lado. Quando se produz a desaceleração repentina do carro, é conectado automaticamente um interruptor, que inicia uma reação química, liberando o gás nitrogênio em quantidade suficiente, conforme a equação a seguir:
6 NaN3(l) + Fe2O3(s) 3 Na2O(s) + 2 Fe(s) + 9 N2(g)
Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de NaN3, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

Barreiro, E.J.; Bolzani, V.S.; Biodiversidade: fonte potencial para a descoberta de fármacos, Quím. Nova, vol.32 (3), 2009. (adaptado).
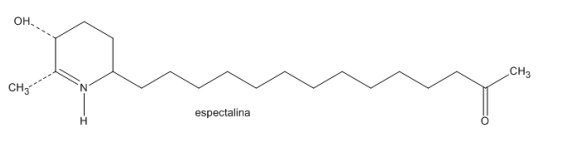
Com base na fórmula estrutural da espectalina mostrada abaixo, obtém-se a massa molar de:
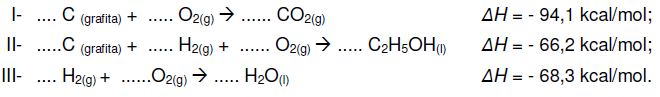
Sabendo-se que a variação de entalpia (∆H) de uma reação qualquer depende somente dos estados iniciais dos reagentes e do estado final dos produtos, marque a alternativa que corresponde aos coeficientes mínimos para a correta estequiometria das reações I, II e III, assim como a quantidade de calor produzida na combustão de 9,2 kg de álcool etílico líquido produzido [C2H5OH(l)], a partir dos coeficientes mínimos encontrados.
Não produzir qualquer tipo de resíduo ou poluente é o principal atributo em favor do hidrogênio como combustível para gerar energia elétrica. Ele faz funcionar células de combustível, equipamentos que produzem eletricidade sem danos ambientais. Como uma das fontes de hidrogênio é a água, uma das alternativas, em consonância com a preocupação ambiental, é o reuso da água como produção de energia renovável, utilizando esgotos e efluentes industriais.
O grupo de professores da Escola de Engenharia de São Carlos/USP desenvolveu um método para produzir hidrogênio em um reator de fluxo contínuo, constantemente alimentado com rejeitos que seriam, muitas vezes, descartados sem tratamento em rios e lagoas. No sistema, bactérias anaeróbicas do gênero Clostridium, que não precisam de oxigênio para viver, aderem a partículas de polietileno dentro de um reator.
Nos automóveis, movidos a células de combustível, o consumo de hidrogênio varia de 1,0 a 10,0g/km rodado, segundo um professor do grupo.
(OLIVEIRA, 2009, p. 100).

Com base nas informações do texto e a partir da análise da
figura, que representa a variação da velocidade escalar, em
função do tempo, de um automóvel movido a célula de
combustível, é correto afirmar que o consumo máximo de
hidrogênio, em g, é de
Dados: R = 0,082 atm.L/mol.K


Esse recipiente tem altura H, em centímetros, equivalente a :
2 Se + Sn -> SnSe2
Em um experimento, deseja-se que haja reação completa, isto é, que os dois reagentes sejam totalmente consumidos. Sabendo-se que a massa molar do selênio (Se) é 2/3 da massa molar do estanho (Sn), a razão entre a massa de selênio e a massa de estanho (mSe : mSn), na reação, deve ser de
