Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões

Assim, pode-se afirmar que um frasco de vidro contendo 100 mL de mercúrio possui uma massa, em Kg, correspondente a:
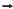 Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é
Al 2 O3(s) , não balanceada, pode-se afirmar que a massa de alumínio necessária para produzir 51 g de óxido de alumínio é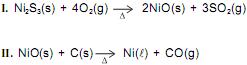
Um dos processos de obtenção do níquel, metal utilizado na fabricação de moedas, consiste, inicialmente, no aquecimento de sulfeto de níquel(III) na presença de ar. Durante esse processo, são formados óxido de níquel(II) e de dióxido de enxofre, de acordo com a equação química I, e, posteriormente, o NiO(s) reage com o carvão, em forno siderúrgico, com obtenção do níquel metálico e do monóxido de carbono, conforme reação representada na equação química II.
Considerando-se as informações do texto e as equações químicas I e II que representam, resumidamente, esse processo, é correto afirmar:
As substâncias químicas têm propriedades bem definidas e, eventualmente, duas substâncias diferentes podem possuir algumas propriedades iguais, mas não todas elas.
Considerando-se essas informações e os dados da tabela que representa algumas propriedades de substâncias químicas, é correto afirmar:
Considere que a análise das cinzas geradas pela queima da casca do fruto de macaúba tenha evidenciado a presença de 0,040 g de óxido de sódio e 0,044 g de óxido de magnésio. Nesse caso, a massa de sódio presente na casca analisada é superior à massa de magnésio.
causou a contaminação da água da região com iodo-131, um
material radioativo. O iodo é a matéria-prima principal que a
glândula tireoide utiliza para a formação de seus hormônios. A
exposição da glândula a altas concentrações desse isótopo pode
levar ao desenvolvimento de nódulos e de câncer da tireoide.
Mulheres grávidas, as que amamentam, fetos, bebês e crianças
constituem a população de maior risco, conforme demonstrado pela
experiência do acidente nuclear de Chernobyl. Para mitigar os
riscos de contaminação, o governo orientou os residentes de áreas
afetadas a ingerir, de forma profilática, iodeto de potássio (KI),
porque o organismo saturado com iodo estável não absorve o
radioativo.
Com relação ao tema acima, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

Com base nesses dados, calcula-se que a massa, em gramas, de gás carbônico liberado para o ar pela reação foi igual a
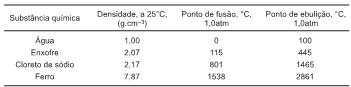
O fluxograma a seguir representa as etapas do processo utilizado para a separação dos polímeros; após cada etapa, as frações são separadas e secas antes de serem submetidas às etapas seguintes.
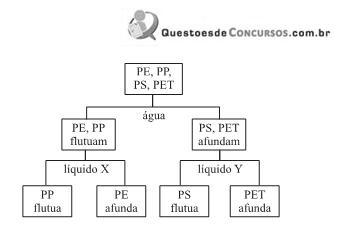
Com respeito aos líquidos utilizados nas etapas finais do processo, é possível dizer que:
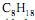
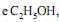 respectivamente. Para liberar a mesma quantidade de energia que 1 L de gasolina, são necessários 1,7 L de álcool, o que corresponde a 6,5 mols de octano e 28,0 mols de etanol, respectivamente. Considerando combustão completa com 100% de eficiência, a relação entre as quantidades de
respectivamente. Para liberar a mesma quantidade de energia que 1 L de gasolina, são necessários 1,7 L de álcool, o que corresponde a 6,5 mols de octano e 28,0 mols de etanol, respectivamente. Considerando combustão completa com 100% de eficiência, a relação entre as quantidades de 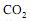 produzidas por 1,7 L de álcool hidratado e 1 L de gasolina será:
produzidas por 1,7 L de álcool hidratado e 1 L de gasolina será:NaCl + MnO2 + H2SO4 → Na2SO4 + Cl2 + H2O
Sabendo que a mesma teve um rendimento de 80% e foi realizada a uma temperatura de 27 °C e a uma pressão de 1 atm e que utilizou 600 g de NaCl, o volume de Cl2 obtido, em litros, foi, aproximadamente,
Considere que um atleta com M kg de massa, partindo do repouso, comece a correr com aceleração constante de a m/s² ; que, enquanto corre, o atleta sofre a ação de uma força de resistência constante igual a R newtons; que toda a energia do atleta resulta da oxidação de gordura, a qual é representada pela expressão a seguir, em que E é a energia, em joules, liberada por mol de gordura.
C3H5O3(OC4H7)3 + 18,502 ? 15CO2 + 13H2O + E
Supondo-se que a eficiência do atleta seja 0, então a expressão matemática que representa a quantidade de moles N de gás carbônico produzido pelo atleta até o tempo t, em segundos, transcorrido desde o momento em que ele iniciou a corrida, é
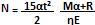
Considere que uma pessoa que pese 60 kg tenha subido, com velocidade constante, uma ladeira de 30° de inclinação, mantendo uma respiração que consome 0,78 L de O2 por minuto. Nesse caso, se toda a produção de energia interna vier da oxidação de glicose, então essa pessoa terá caminhado, em uma hora, menos de 3,5 km.



